题目内容
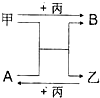 甲、乙、丙是三种单质,A、B是两种化合物,它们相互间有如图转化关系.请回箸下列问题:
甲、乙、丙是三种单质,A、B是两种化合物,它们相互间有如图转化关系.请回箸下列问题:(1)若甲为非金属.A是由两种短周期元素的原子构成的且只有一个α键的极性分子,乙和丙在冷暗处就能剧烈反应;则A的电子式为
(2)若甲的基态原子外围电子排布式为3s2,A是由第二周期两种元素的原子构成的非极性气态分子,则乙元素在周期表中的位置是
化学方程式
(3)若甲、乙均为金属单质,化合物B具有两性,任意写出-例甲与A反应的化学方程式
考点:无机物的推断
专题:推断题
分析:甲、乙、丙是三种单质,A、B是两种化合物,甲和A的反应为置换反应,
(1)乙和丙在冷暗处就能剧烈反应,应为F2和H2的反应,则A为HF,甲为Si,丙为F2,B为SiF4,乙为H2;
(2)若甲的基态原子外围电子排布式为3s2,应为Mg,A是由第二周期两种元素的原子构成的非极性气态分子,能与镁发生置换反应,则应为CO2,由转化干系可知B为MgO,乙为C,丙为O2;
(3)若甲、乙均为金属单质,发生置换反应,应为铝热反应,化合物B具有两性,应为Al2O3,可知甲为Al,丙为O2,乙为较铝的活泼性弱的金属单质.
(1)乙和丙在冷暗处就能剧烈反应,应为F2和H2的反应,则A为HF,甲为Si,丙为F2,B为SiF4,乙为H2;
(2)若甲的基态原子外围电子排布式为3s2,应为Mg,A是由第二周期两种元素的原子构成的非极性气态分子,能与镁发生置换反应,则应为CO2,由转化干系可知B为MgO,乙为C,丙为O2;
(3)若甲、乙均为金属单质,发生置换反应,应为铝热反应,化合物B具有两性,应为Al2O3,可知甲为Al,丙为O2,乙为较铝的活泼性弱的金属单质.
解答:
解:(1)乙和丙在冷暗处就能剧烈反应,应为F2和H2的反应,则A为HF,电子式为 ,甲为Si,丙为F2,B为SiF4,结构式为
,甲为Si,丙为F2,B为SiF4,结构式为 ,乙为H2,
,乙为H2,
故答案为: ;
; ;
;
(2)若甲的基态原子外围电子排布式为3s2,应为Mg,A是由第二周期两种元素的原子构成的非极性气态分子,能与镁发生置换反应,则应为CO2,由转化干系可知B为MgO,乙为C,丙为O2,C位于周期表第二周期Ⅳ族,甲和丙反应的化学方程式2Mg+O2
2MgO,
故答案为:第二周期Ⅳ族; 2Mg+O2
2MgO;
(3)若甲、乙均为金属单质,发生置换反应,应为铝热反应,化合物B具有两性,应为Al2O3,可知甲为Al,丙为O2,乙为较铝的活泼性弱的金属单质,可为铝和氧化铁的反应,方程式为2Al+Fe2O3
Al2O2+2Fe,此时乙为Fe,原子基态电子排布式为1s22s22p43s23p63d64s2,
故答案为:2Al+Fe2O3
Al2O2+2Fe;1s22s22p43s23p63d64s2.
 ,甲为Si,丙为F2,B为SiF4,结构式为
,甲为Si,丙为F2,B为SiF4,结构式为 ,乙为H2,
,乙为H2,故答案为:
 ;
; ;
;(2)若甲的基态原子外围电子排布式为3s2,应为Mg,A是由第二周期两种元素的原子构成的非极性气态分子,能与镁发生置换反应,则应为CO2,由转化干系可知B为MgO,乙为C,丙为O2,C位于周期表第二周期Ⅳ族,甲和丙反应的化学方程式2Mg+O2
| ||
故答案为:第二周期Ⅳ族; 2Mg+O2
| ||
(3)若甲、乙均为金属单质,发生置换反应,应为铝热反应,化合物B具有两性,应为Al2O3,可知甲为Al,丙为O2,乙为较铝的活泼性弱的金属单质,可为铝和氧化铁的反应,方程式为2Al+Fe2O3
| ||
故答案为:2Al+Fe2O3
| ||
点评:本题考查无机物的推断,为高频考点,是对重要的元素及其化合物进行了考查,框图推断题一直是高考中的一种重要题型,试题综合性强,具有一定难度,答题时注意把握突破口.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
下列化学实验事实及其解释或结论都正确的是( )
| A、向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 |
| B、取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
| C、用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH |
| D、向10mL 0.1 mol/L的AgNO3溶液中滴加10滴0.1 mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1 mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度大于AgI的溶解度 |
对于固定体积的密闭容器中进行的气体反应可以说明A(g)+B(g)?C(g)+D(g)在恒温下已达到平衡的是( )
| A、反应容器的压强不随时间而变化 |
| B、A气体和B气体的生成速率相等 |
| C、A、B、C三种气体的生成速率相等 |
| D、反应混合气体的密度不随时间而变化 |
下列各项比较中不正确的是( )
| A、电负性:F>O>N |
| B、第一电离能:Mg>Al>Na |
| C、结合质子能力:OH-<CH3COO-<Cl- |
| D、稳定性:H2O>H2S>H2Se |
下列说法正确的是( )
| A、将试管直立,然后向其中加入块状大理石 |
| B、向盛有某溶液的试管中倾倒稀硫酸检验是否有Ba2+存在 |
| C、实验用完的药品一定要放回原试剂瓶中 |
| D、过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
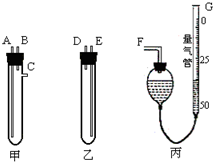 某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:
某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题: