题目内容
下列说法中错误的是( )
| A、需要加热才能发生的反应一定是吸热反应 |
| B、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C、反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
| D、化学反应中的能量变化通常表象为热量的变化 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、反应放热还是吸热与反应条件无关,决定于反应物和生成物的能量高低;
B、化学反应中能量变化的根本原因就是旧键断裂与新键形成;
C、△H=生成物的能量和-反应物的能量和;
D、化学反应的能量变化形成很多,有热能、光能、电能等等,但通常表现为热能.
B、化学反应中能量变化的根本原因就是旧键断裂与新键形成;
C、△H=生成物的能量和-反应物的能量和;
D、化学反应的能量变化形成很多,有热能、光能、电能等等,但通常表现为热能.
解答:
解:A、燃烧需要加热到着火点,但是放热反应,故A错误;
B、化学反应中能量变化的根本原因就是旧键断裂与新键形成,故B正确;
C、△H=生成物的能量和-反应物的能量和,故C正确;
D、化学反应的能量变化形成很多,有热能、光能、电能等等,但通常表现为热能,故D正确.
故选:A.
B、化学反应中能量变化的根本原因就是旧键断裂与新键形成,故B正确;
C、△H=生成物的能量和-反应物的能量和,故C正确;
D、化学反应的能量变化形成很多,有热能、光能、电能等等,但通常表现为热能,故D正确.
故选:A.
点评:题目考查了焓变与反应条件无关以及焓变的计算过程,能量变化的主要形式,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
NA为阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,11.2L的戊烷所含的分子数为0.5NA |
| B、28g乙烯所含共用电子对数目为4NA |
| C、1mol甲基的电子数目为7NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
等物质的量的下列各有机物完全燃烧,生成CO2和H2O,耗氧量最多的是( )
| A、CH4O |
| B、C2H4O2 |
| C、C6H6 |
| D、C4H10 |
下列说法或表示正确的是( )
| A、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量少 |
| B、A、B互为同素异形体,由A转化为B时△H═+119 kJ?mol-1可知B比A稳定 |
| C、对△H<0的化学反应,不需要加热,一定能够自发进行到底 |
| D、在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H═-571.6kJ?mol-1,则H2在101kPa时的燃烧热为571.6kJ?mol-1 |
下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A、它们的氢化物的稳定性随核电荷数的增加而增强 |
| B、它们单质的氧化性依次减弱 |
| C、它们的原子核外电子层数随核电荷数的增加而增多 |
| D、单质的颜色随核电荷数的增加而加深 |
下列有关化学用语使用正确的是( )
A、硫原子的原子结构示意图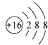 | ||
B、NH4Cl的电子式: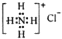 | ||
C、原子核内有10个中子的氧原子:
| ||
| D、基态铜原子的电子排布式为:1s22s22p63s23p63d94s2 |