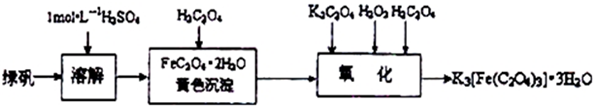
题目内容
11.NA表示阿伏加德罗常数的值,下列有关说法正确的是( )| A. | 12g石墨和C60的混合物中质子总数为6NA | |
| B. | 1L1mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 反应KIO3+6HI=KI+3H2O+3I2中,生成1molI2转移电子的总数为2NA | |
| D. | 1.8g2H2O所含中子总数为NA |
分析 A、石墨和C60均由碳原子构成;
B、甲醇水溶液中,除了甲醇外,水也含氢原子;
C、反应KIO3+6HI=KI+3H2O+3I2转移5mol电子生成3mol碘单质;
D、2H2O的摩尔质量为20g/mol.
解答 解:A、石墨和C60均由碳原子构成,故12g混合物中含有的碳原子的物质的量为1mol,则含6NA个质子,故A正确;
B、甲醇水溶液中,除了甲醇外,水也含氢原子,故溶液中含有的氢原子的个数多于4NA个,故B错误;
C、反应KIO3+6HI=KI+3H2O+3I2转移5mol电子生成3mol碘单质,故当生成1mol碘单质时转移$\frac{5}{3}$NA个电子,故C错误;
D、2H2O的摩尔质量为20g/mol,故1.8g2H2O的物质的量小于0.9mol,则含有的中子数为0.9NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列说法不正确的是( )
| A. | “埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 | |
| B. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,新修订的《环境空气质量标准》增设了PM2.5 平均浓度限值,是因为PM2.5在空气中形成了分散系一定是气溶胶,且富含有害物质,对空气质量影响较大 | |
| D. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
2.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 100 mL 1 mol•L-1的NaHCO3溶液中,含有HCO3-与CO32-的数目之和为0.1 NA | |
| B. | 用惰性电极电解MgCl2溶液,导线中流过2NA个e-时,生成24 g Mg | |
| C. | 标准状况下,11.2 L C2H6中含有极性键的数目为3.5NA | |
| D. | 常温常压下,20 g H218O中含有的中子数目为10NA |
3.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 | 主要原因是:H++NO2-═HNO2, 2HNO2═NO↑+NO2↑+H2O |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 |
| C | 向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生. | 阿司匹林彻底水解 |
| D | 向1mL1.0mol•L-1AlCl3溶液中滴加2mL10% NH4F溶液,再滴加1mL 3.0mol•L-1NH3•H2O溶液,无沉淀生成. | Al3+更易与F-结合成AlF63- |
| A. | A | B. | B | C. | C | D. | D |
20.化学与人类生产、生活、可持续发展密切相关,下列说法正确的是( )
| A. | 生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石 | |
| B. | 居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体 | |
| C. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| D. | 某雨水样品放置一段时间后pH由4.68变为4.28,是因为吸收了CO2 |

 .
. ;由F生成一硝化产物的化学方程式为
;由F生成一硝化产物的化学方程式为 ,该产物的名称是2-硝基-1,4-苯二甲酸.
,该产物的名称是2-硝基-1,4-苯二甲酸. }及阻燃剂四溴双酚A.合成线路如图:
}及阻燃剂四溴双酚A.合成线路如图:

 $\stackrel{溴化钠、氯化钠、盐酸}{→}$
$\stackrel{溴化钠、氯化钠、盐酸}{→}$
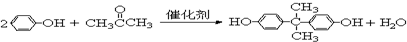 .
. =CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$
=CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$ =CHCOOR+2H2O,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
=CHCOOR+2H2O,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: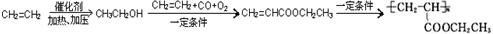 .
.
 ,Y的名称是浓硫酸
,Y的名称是浓硫酸