题目内容
16.如图表示几种无机物之间的转化关系.其中A、B均为黑色粉末,C为无色气体,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色.
请回答下列问题:
(1)A的化学式是CuO,C的电子式是
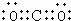 ,Y的名称是浓硫酸
,Y的名称是浓硫酸(2)反应①的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(3)用石墨作电极电解H的水溶液,电解总反应的离子方程式是2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+.
(4)推测反应③的化学方程式为SO2+NO2+H2O═H2SO4+NO.
(5)A和B反应的化学方程式为2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑.
分析 E是红棕色气体,则E为NO2,B为黑色粉末,与X反应得到NO2及无色气体C,则B为碳,X为浓硝酸,无色气体C为CO2,则F为H2O.H的水溶液呈蓝色,含有Cu2+,D与Y反应生成H含有Cu2+、水及具有漂白性的气体G,应是Cu与浓硫酸反应,则D为Cu、Y为浓硫酸、G为SO2、H为CuSO4.碳与黑色物质A反应生成CO2、Cu,则A为CuO.
解答 解:E是红棕色气体,则E为NO2,B为黑色粉末,与X反应得到NO2及无色气体C,则B为碳,X为浓硝酸,无色气体C为CO2,则F为H2O.H的水溶液呈蓝色,含有Cu2+,D与Y反应生成H含有Cu2+、水及具有漂白性的气体G,应是Cu与浓硫酸反应,则D为Cu、Y为浓硫酸、G为SO2、H为CuSO4.碳与黑色物质A反应生成CO2、Cu,则A为CuO.
(1)由上述分析可知,A为CuO;C为CO2,其电子式为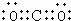 ;Y为浓硫酸,
;Y为浓硫酸,
故答案为:CuO;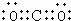 ;浓硫酸;
;浓硫酸;
(2)反应①为碳与浓硝酸反应生成二氧化碳、二氧化氮与水,化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)用石墨作电极电解CuSO4的水溶液,阳离子为铜离子放电,阴离子为氢氧根离子放电,电解生成铜、硫酸与氧气,电解总反应的离子方程式为:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+;
(4)NO2具有强氧化性,SO2具有还原性,在水中反应生成硫酸与NO,还原产物可能是NO,反应方程式为:SO2+NO2+H2O═H2SO4+NO,
故答案为:SO2+NO2+H2O═H2SO4+NO;
(5)A和B反应的化学方程式为:2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑,故答案为:2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑.
点评 本题考查无机物的推断,物质的颜色与性质是推断突破口,再结合转化关系进行推断,熟练掌握元素化合物想性质.

| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
| 选项 | 实验方案 | 实验目的或结论 |
| A | 取一个小木条,放入饱和硅酸钠溶液中,充分吸湿、浸透,取出稍沥干后,置于酒精灯外焰处,木条未燃烧 | 证明硅酸钠可作木材防火剂 |
| B | 向取好未知浓度氢氧化钠溶液的锥形瓶中加入2mL酚酞,然后进行正确滴定,最后一滴盐酸滴入,溶液由红色变为无色且半分钟不恢复 | 准确判断已知浓度的盐酸滴定未知浓度的氢氧化钠溶液的滴定的终点 |
| C | 向装有石灰石的简易启普发生器中加入浓醋酸,将产生的气体先通入过量饱和碳酸氢钠溶液,再通入苯酚钠溶液中,苯酚钠溶液产生浑浊 | 酸性:醋酸>碳酸>苯酚 |
| D | 向盛有苯酚的浓溶液的试管里逐滴加入稀溴水,边滴边振荡 | 苯酚的定性检验 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 12g石墨和C60的混合物中质子总数为6NA | |
| B. | 1L1mol/L的甲醇水溶液中含有氢原子总数为4NA | |
| C. | 反应KIO3+6HI=KI+3H2O+3I2中,生成1molI2转移电子的总数为2NA | |
| D. | 1.8g2H2O所含中子总数为NA |
| A. | 海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| B. | 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 | |
| C. | 日本福岛核电站爆炸时释放的两种放射性核素131I与137Cs(铯)的中子数相等 | |
| D. | 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
| A. | 将造纸废水通过高压水井压到地下或溶洞中,可减少污染 | |
| B. | 煤的气化和液化能提高煤的利用率、减少污染 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 煤的干馏、石油的分馏为物理变化 |

 )外,还得到它的同分异构体,其中B、C、D、E、F、分别代表一种或多种物质.已知:
)外,还得到它的同分异构体,其中B、C、D、E、F、分别代表一种或多种物质.已知: (R1,R2,R3,R4为烃基或H)
(R1,R2,R3,R4为烃基或H) .
. ;
; .
.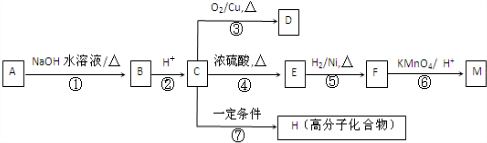
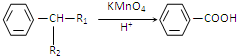 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)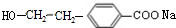 、
、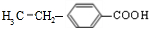 ;
; ;反应⑦的化学方程式为
;反应⑦的化学方程式为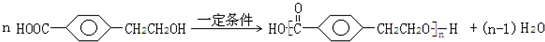 .
.