题目内容
检验溶液中是否含有某种离子,下列操作方法正确的是( )
| A、向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl- |
| B、向某溶液中加稀 HCl,无明显现象,再加入BaCl2 溶液产生白色沉淀,证明有SO42- |
| C、向某溶液中加入稀 HCl,放出能使澄清的石灰水变浑浊的气体,证明有CO32- |
| D、加浓氢氧化钠溶液后加热,产生使湿润蓝色石蕊试纸变红的气体,证明含有NH4+ |
考点:常见阴离子的检验,常见阳离子的检验
专题:
分析:A、能和AgNO3溶液产生白色沉淀的除了Cl-,还有CO32-、SO32-等;
B、加入盐酸后排除了干扰离子,再加入氯化钡,若生成了白色沉淀,该白色沉淀为硫酸钡,则原溶液中一定含有硫酸根离子;
C、该气体为二氧化碳,原溶液中可能含有碳酸氢根离子,不一定含有碳酸根离子;
D、氨气使湿润的红色石蕊试纸变蓝;
B、加入盐酸后排除了干扰离子,再加入氯化钡,若生成了白色沉淀,该白色沉淀为硫酸钡,则原溶液中一定含有硫酸根离子;
C、该气体为二氧化碳,原溶液中可能含有碳酸氢根离子,不一定含有碳酸根离子;
D、氨气使湿润的红色石蕊试纸变蓝;
解答:
解:A、能和AgNO3溶液产生白色沉淀的除了Cl-,还有CO32-等,故在加AgNO3溶液前,必须先加稀硝酸,故正确的检验方法是:先向溶液中加稀硝酸,再加AgNO3溶液产生白色沉淀,证明有Cl-,故A错误;
B、向某溶液中加入足量的盐酸无明显现象,说明溶液中不存在银离子,然后再加入BaCl2溶液,产生白色沉淀,该白色沉淀为硫酸钡,证明原溶液中存在硫酸根离子,故B正确;
C、向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体,该气体为二氧化碳,但是原溶液中可能含有碳酸氢根离子,不一定含有碳酸根离子,故C错误;
D、氨气使湿润的红色石蕊试纸变蓝,检验方法中试纸不合理,故D错误;
故选B.
B、向某溶液中加入足量的盐酸无明显现象,说明溶液中不存在银离子,然后再加入BaCl2溶液,产生白色沉淀,该白色沉淀为硫酸钡,证明原溶液中存在硫酸根离子,故B正确;
C、向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体,该气体为二氧化碳,但是原溶液中可能含有碳酸氢根离子,不一定含有碳酸根离子,故C错误;
D、氨气使湿润的红色石蕊试纸变蓝,检验方法中试纸不合理,故D错误;
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及知识点较多,侧重实验基本操作和物质推断的考查,把握混合物分离方法及操作、离子的检验及焰色反应等为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
在一定的温度下,向一密闭容器中放入 1mol A 和 1mol B,发生下列反应:A(g)+B(g)?C(g)+2D(g),平衡状态时,C的含量为m%,保持温度不变,若按照下列配比在上述容器中放入起始物质,达到平衡状态时C的含量仍然为m%的是( )
| A、2molA+1molB |
| B、1molC+1molD |
| C、2molC+2molD |
| D、0.5molA+0.5molB+0.5molC+1molD |
下列物质属于电解质的是( )
| A、石墨 |
| B、NaOH溶液 |
| C、乙醇 |
| D、Na2CO3 |
已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引.
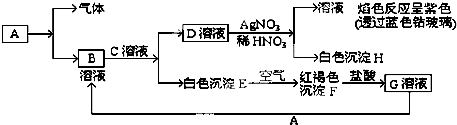
(1)试回答:写出B的化学式 C的化学式 H的化学式
(2)写出由E转变成F的化学方程式 .
(3)向G溶液加入A的有关离子反应方程式 .

(1)试回答:写出B的化学式
(2)写出由E转变成F的化学方程式
(3)向G溶液加入A的有关离子反应方程式
下列说法正确的是( )
| A、相对分子质量相同的物质一定是同种物质 |
| B、相对分子质量相同的不同物质一定是同分异构体 |
| C、白磷和红磷互为同分异构体 |
| D、分子式相同的不同物质一定互为同分异构体 |
用NaCl固体配制0.1mol?L-1的NaCl溶液,下列操作或说法正确的是( )
| A、若在移液过程中,溶液溅出容量瓶,则应重新配制溶液 |
| B、将5.85gNaCl固体溶于1 L水中可配成0.1 mol?L-1的NaCl溶液 |
| C、固体直接转移到容量瓶中,并加水稀释到刻度线 |
| D、称量时,将固体NaCl直接放在天平左盘上 |

