题目内容
 铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O研读图,下列判断不正确的是( )
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O研读图,下列判断不正确的是( )| A、K 闭合时,d电极反应式PbSO4+2H2O-2e-=PbO2+4H++SO42- |
| B、当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2 mol |
| C、K闭合时,II中SO42-向c电极迁移 |
| D、K闭合一段时间后,II可单独作为原电池,d电极为负极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.K闭合时,Ⅰ装置是一个原电池,Ⅱ是一个电解池,根据电解池的工作原理来回答;
B.根据化学反应中电子的转移来回答;
C.阴离子向阳极移动;
D.K闭合一段时间后,Ⅱ可单独作为原电池,析出铅的电极是负极.
B.根据化学反应中电子的转移来回答;
C.阴离子向阳极移动;
D.K闭合一段时间后,Ⅱ可单独作为原电池,析出铅的电极是负极.
解答:
解:A.K闭合时Ⅰ为原电池,Ⅱ为电解池,Ⅱ中发生充电反应,d电极为阳极发生氧化反应,其反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42-,故A正确;
B.在上述总反应式中,得失电子总数为2e-,当电路中转移0.2mol电子时,可以计算出Ⅰ中消耗的硫酸的量为0.2mol,故B正确;
C.当k闭合时I为原电池、II电解池,II中c电极上的PbSO4转化为Pb和SO42-,d电极上的PbSO4转化为PbO2和SO42-,故SO42-从两极上脱离下来向阳极移动,即向d电极移动,故C错误;
D.K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时做电源的负极,d表面生成PbO2,做电源的正极,故D错误.
故选CD.
B.在上述总反应式中,得失电子总数为2e-,当电路中转移0.2mol电子时,可以计算出Ⅰ中消耗的硫酸的量为0.2mol,故B正确;
C.当k闭合时I为原电池、II电解池,II中c电极上的PbSO4转化为Pb和SO42-,d电极上的PbSO4转化为PbO2和SO42-,故SO42-从两极上脱离下来向阳极移动,即向d电极移动,故C错误;
D.K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时做电源的负极,d表面生成PbO2,做电源的正极,故D错误.
故选CD.
点评:本题考查了原电池和电解池的相关知识,题目难度不大,注意根据根据反应方程式判断电解池和原电池,注意把握电极方程式的书写方法.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | ||||
| B、钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O=4OH- | ||||
| C、足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl- | ||||
D、用铁作电极电解饱和食盐水:2Cl-+2H2O
|
下列说法正确的是( )
| A、水晶、红宝石、珍珠、钻石等装饰品的主要成分都是硅酸盐 |
| B、石油裂解、煤的气化、海水制镁等过程中都包含化学变化 |
| C、有新单质生成的化学反应,一定属于氧化还原反应 |
| D、二氧化硫有漂白、杀菌性能,可在食品加工中大量使用 |
下列说法正确的是( )
| A、分子中含有两个氢原子的酸一定是二元酸 |
| B、向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
| C、明矾可用于水的消毒、杀菌 |
| D、葡萄糖注射液不能产生丁达尔效应,不属于胶体 |
NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、1.0L 1.0mol?L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| B、1mol醋酸的质量与NA个醋酸分子的质量一定相等 |
| C、2.24L CO2中含有的原子数为0.3NA |
| D、0.1mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA |
下列实验操作与安全事故处理错误的是( )
| A、使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 | ||
B、用试管夹从试管底由下往上夹住试管口约
| ||
| C、制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 | ||
| D、把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中 |
下列液体可以用来保存金属钠的是( )
| A、水 |
| B、浓NaOH溶液 |
| C、煤油 |
| D、CCl4(d>1g/cm3) |
下列各组物质中,属于同系物的是( )
| A、CH3Cl CH3CH2Cl |
B、 |
| C、CH3COOH、CH3CH2OH |
| D、HCHO、CH3COOH |
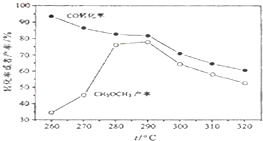 (除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图:
(除零班外其它班做) 一碳化学是国际研究的热点,有研究者在催化剂和压强为5.0MPa的条件下由H2和CO直接制备二甲醚,其反应为:2CO(g)+4H2(g)═CH3-O-CH3(g)+H2O(g),有关图象如图: