题目内容
19分)实验室欲用胆矾配制250 mL0.2 mol·L-1的CuSO4溶液。
(1)配制溶液时,一般可以分为以下几个步骤:(完成下列空格)
A 计算B 称量 C.溶解D.______E. ______F. 定容 G. 摇匀、装瓶
(2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、量筒还有______
和______ (填仪器名称)
(3)经计算需要称取CuSO4·5H2O的质量为______ 。
(4)若称取胆矾时砝码被放在左盘(10g以下用游码),则配制的CuSO4溶液的浓度______ (填“偏高”、“偏低”、“无影响”);若定容时仰视刻度线,则配制的CuSO4溶液的浓度______ (填“偏高”、“偏低”、“无影响”)。
(5)从准确配制好的CuSO4溶液中取出50mL ,则这50mL CuSO4溶液的物质的量浓度为______________,所含Cu2+的质量为。
(1)D. 转移 E.洗涤(2) 250 mL容量瓶、胶头滴管(3)12.5g (4)偏低;偏低(5)0.2 mol·L-10.64g
解析试题解析:(1)配制步骤有计算、称量、溶解、转移、洗涤、定容、摇匀等;(2)根据各步操作需要,还需用到的仪器是250mL容量瓶、胶头滴管;(3)n=cV=0.25L×0.2mol/L=0.05mol,m=nM=250g/mol×0.05mol=12.5g;(4)称量固体质量时物码倒置使m偏低,则n偏低,由c=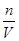 知,浓度偏低;定容时仰视刻度线仰视刻度线使V偏高,由c=
知,浓度偏低;定容时仰视刻度线仰视刻度线使V偏高,由c=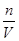 知,浓度偏低;(5)溶液浓度与体积无关,故该50ml溶液的浓度为0.2 mol·L-1;n=cV=0.05L×0.2mol/L=0.01mol,m=nM=64g/mol×0.01mol=0.64g。
知,浓度偏低;(5)溶液浓度与体积无关,故该50ml溶液的浓度为0.2 mol·L-1;n=cV=0.05L×0.2mol/L=0.01mol,m=nM=64g/mol×0.01mol=0.64g。
考点:一定物质的量浓度溶液的配制

化学与环境、材料、信息、能关系密切,下列说法正确的是
| A.半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B.绿色化学的核心是利用化学原理治理环境污染 |
| C.将煤气化或液化,获得清洁燃料 |
| D.PM2.5是指大气中直径接近于2.5×10-6 m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物具有丁达尔效应 |
(14分)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4 +16HCl(浓) 2KCl + 2MnCl2 + 5Cl2↑ +8H2O
(1)用单线桥法标出电子转移的方向和数目。
(2)该反应中的氧化剂与还原剂物质的量之比是 。
(3)KMnO4的氧化性比Cl2的氧化性 (选填“强”或“弱”)。
(4)如反应中转移了2mol电子,则产生的Cl2在标准状况下体积为 L。
(5)某同学欲用KMnO4固体配制100 mL0.5mol.L-1的溶液。回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、 、 。
②应用托盘天平称取KMnO4固体 g。
③不规范的实验操作会导致实验结果的误差。分析下列操作对实验结果的影响偏小的是(请填序号) 。
| A.加水定容时俯视刻度线 |
| B.容量瓶内壁附有水珠而未干燥处理 |
| C.颠倒摇匀后发现凹液面低于刻度线又加水补上 |
| D.在溶解过程中有少量液体溅出烧杯外 |
(10分)把18.0mol·L-1的浓硫酸稀释成2.00mol·L-1的稀硫酸100ml,实验操作如下:
| A.将配好的稀硫酸倒入试剂瓶中,贴好标签; |
| B.盖好容量瓶塞,反复颠倒,摇匀; |
| C.用量筒量取ml的18.0mol·L-1的浓硫酸; |
| D.将沿烧杯内壁慢慢注入盛有少量的烧杯中; |
F.将已冷却至室温的硫酸溶液沿玻璃棒注入 mL的容量瓶中;
G.改用胶头滴管逐滴加蒸馏水,使溶液凹面恰好与刻度相切;
H.继续向容量瓶中加蒸馏水,直到液面接近刻度线 cm处。
(1)填写上述步骤中的空白:
C ;D ;F ;H 。
(2)请按正确的操作步骤进行排序 。
(3)试分析下列操作会使所配溶液的浓度与2.00 mol·L-1相比(填偏大、偏小或不变)?
①若在操作中没有把洗涤烧杯和玻璃棒的洗涤液全部转移到容量瓶中,会使稀硫酸溶液的浓度 。
②若容量瓶未干燥即用来配制溶液, 。
③若定容时俯视刻度线,会使稀硫酸溶液的浓度 。
下列反应原理不符合工业冶炼金属实际情况的是
A.2HgO 2Hg+O2↑ 2Hg+O2↑ |
B.2NaCl(熔融) 2Na+Cl2↑ 2Na+Cl2↑ |
C.2MgO(熔融) 2Mg+O2↑ 2Mg+O2↑ |
D.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
