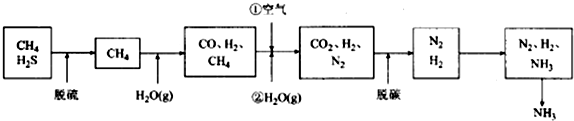
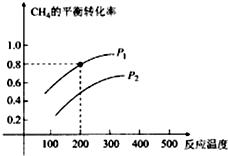
题目内容
1.(1)写出表示含有8个质子,10个中子的原子的化学符号:${\;}_{8}^{18}$O.(2)根据下列微粒回答问题:${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、14C、14N、16O、35Cl2、37Cl2.
①以上8种微粒共有6种核素,共5种元素.
②互为同位素的是H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H.
③质量数相等的是14C和14N,中子数相等的是14C和16O.
(3)相同物质的量的14CO2与S18O2的质量之比为23:34;中子数之比为2:3;电子数之比为11:16.
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是:Li或Na.(铷的相对原子量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为10:9.
分析 (1)原子的表示方法为${\;}_{Z}^{A}X$,含有8个质子的元素是O;
(2))①质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;
②质子数相同,而中子数不同的原子,互称为同位素;
③原子符号左上角的数字为质量数;中子数=质量数-质子数;
(3)根据m=nM计算相同物质的量的14CO2与S18O2的质量比,14CO2与S18O2每个分子都含有2个O原子,分别含有1个碳原子和1个硫原子,1个碳原子含8个中子、6个质子,1个硫原子含有16个质子,16个中子,14CO2中1个氧原子含有8个质子,8个中子,1个S18O2中1个氧原子含有8个质子、10个中子;
(4)钾和另一种碱金属在化合物中的化合价均为+1价,由2M+2H2O═2MOH+H2↑计算出金属的物质的量,再计算出合金的平均摩尔质量,利用平均摩尔质量的进行判断;
(5)根据n=$\frac{m}{M}$计算H2O和D2O的物质的量之比,发生反应2Na+2H2O=2NaOH+H2↑,2Na+2D2O=2NaOD+D2↑,根据方程式可知生成H2、D2的物质的量之比等于H2O和D2O的物质的量之比,相同体积气体体积之比等于其物质的量之比.
解答 解:(1)含有8个质子的元素是O,质量数=质子数+中子数=8+10=18,因此化学符号为${\;}_{8}^{18}$O,
故答案为:${\;}_{8}^{18}$O;
(2)①质子数和中子数只要其一不相同就属于不同核素:${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、14C、14N、16O、分别为一种核素,共6种,${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H都属于氢元素,14C属于碳元素,14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有5种元素,
故答案为:6;5;
②${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H都属于氢元素,质子数相同,而中子数不同互为同位素,故答案为:${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H;
③原子符号左上角的数字为质量数,则质量数相等的是14C和14N,14C中中子数=14-6=8,16O 的中子数=16-8=8,所以二者中子数相同,
故答案为:14C;14N; 14C;16O;
(3)根据m=nM,相同物质的量的14CO2与S18O2的质量比为摩尔质量比即46:68=23:34,14CO2中1个碳原子含8个中子、6个质子,1个氧原子含有8个质子,8个中子,
1个14CO2中含中子数为24,含质子数为22,S18O2中1个硫原子含有16个质子,16个中子,1个氧原子含有8个质子、10个中子,1个S18O2中含中子数为36,含质子数为32,所以相同物质的量的14CO2与S18O2的中子数之比为24:36=2:3,分子质子数等于电子数,所以两者电子数之比为22:32=11:16,
故答案为:23:34;2:3;11:16;
(4)0.2g氢气的物质的量为:$\frac{0.2g}{2g/mol}$=0.1mol,则
2M+2H2O═2MOH+H2↑,
2 1
0.2mol 0.1mol
则合金的平均摩尔质量为:M=$\frac{7.8g}{0.2mol}$=39g/mol,
铷的相对原子量取85.5,则铷的摩尔质量为85.5g/mol,则另一种碱金属的摩尔质量一定小于39g/mol,
故另一碱金属可能是Li或Na,
故答案为:Li或Na;
(5)质量相同的H2O和D2O的物质的量之比为$\frac{1}{18}$:$\frac{1}{20}$=10:9,由2Na+2H2O=2NaOH+H2↑、2Na+2D2O=2NaOD+D2↑,可知H2、D2的物质的量之比等于H2O和D2O的物质的量之比,即H2、D2的物质的量之比为10:9,相同体积气体体积之比等于其物质的量之比,故H2、D2的体积之比为10:9,
故答案为:10:9.
点评 本题主要考查了核数的种类、元素的种类、同位素的概念以及核外电子数的计算,题目难度不大,注意以物质的量为中心的计算公式的灵活运用.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | 将10 mL该溶液稀释至100 mL后,pH=4 | |
| B. | 向该溶液中加入等体积pH为12的氨水恰好完全中和 | |
| C. | 该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1 | |
| D. | 该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14 |
| A. | 酸式滴定管在装酸液前未用待装液润洗2~3次,使测定结果偏大 | |
| B. | 滴定终点时,俯视读数,使测定结果偏小 | |
| C. | 只能选用酚酞作指示剂 | |
| D. | 滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点 |
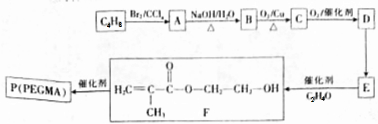
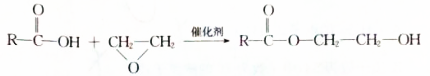
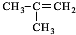 .
.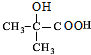 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$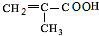 +H2O,该反应的反应类型是消去反应.
+H2O,该反应的反应类型是消去反应.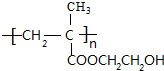 .
.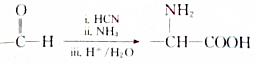 .设计由B合成
.设计由B合成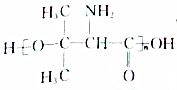 的路线.合成路线流程图请参考如下形式.
的路线.合成路线流程图请参考如下形式.
 .
.

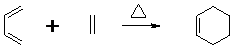
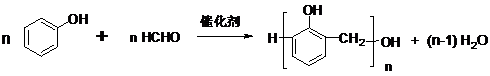
 ⑤
⑤ ⑧
⑧ ⑨
⑨ .
.