题目内容
16.将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g),在一定条件下2min时达到平衡,测得c(SO3)=0.04mol•L-1.以下表述正确的是( )| A. | 若恒容下,充入氮气,则c(SO3)小于0.04mol•L-1 | |
| B. | 该条件下反应的平衡常数为1.6×103 | |
| C. | v(O2)=0.02 mol•L-1.min-1 | |
| D. | 使用催化剂若平衡没有移动,则该反应达到化学平衡状态 |
分析 A.恒容下,充入氮气,反应混合物各组分浓度不变,平衡不移动;
B.将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,在一定条件下2min时达到平衡,测得c(SO3)=0.04mol•L-1,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):0.05 0.03 0
变化浓度(mol/L):0.04 0.02 0.04
平衡浓度(mol/L):0.01 0.01 0.04
再根据K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$计算平衡常数;
C.根据v=$\frac{△c}{△t}$计算v(O2);
D.催化剂不影响平衡移动.
解答 解:A.恒容下,充入氮气,反应混合物各组分浓度不变,平衡不移动,c(SO3)不变,故A错误;
B.将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,在一定条件下2min时达到平衡,测得c(SO3)=0.04mol•L-1,则:
2SO2(g)+O2(g)?2SO3(g)
起始浓度(mol/L):0.05 0.03 0
变化浓度(mol/L):0.04 0.02 0.04
平衡浓度(mol/L):0.01 0.01 0.04
则平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{0.0{4}^{2}}{0.0{1}^{2}×0.01}$=1.6×103,故B正确;
C.2min时达到平衡,氧气浓度变化量为0.02mol/L,则v(O2)=$\frac{0.02mol/L}{2min}$=0.01mol/(L.min),故C错误;
D.催化剂不影响平衡移动,无法判断反应是否到达平衡,故D错误,
故选:B.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数计算,难度不大,注意三段式在化学平衡计算中应用.

(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol.
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ•mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②700℃反应达到平衡后,要使反应速率增大且平衡向右移动,可采取的措施有增加CO2的量或者升高温度.
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O=CO2+6H+,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=1(溶液电解前后体积的变化忽略不计).
| A. | H+ Na+ S2- CO32- | B. | H+ Ca2+ MnO4- NO3- | ||
| C. | K+ Ca2+ Cl- HCO3- | D. | Cl- Mg2+ Al3+ SO42- |
| A. | 在标准状况下22.4LH2中含有的氢分子的个数为NA | |
| B. | 1L1mol/L的KClO3溶液中含有的Cl-个数为NA | |
| C. | 加入盐酸,放出能使澄清的石灰水变浑浊的无色无味的气体,证明一定含有CO32- | |
| D. | 某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
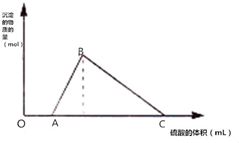 将M克钠和铝的混合物投入到一定量的水中,金属全部溶解,并收集到标准状况下体积为N升的气体,在所得溶液中逐滴加入1mol/L H2SO4,所得沉淀的物质的量随滴入硫酸溶液的体积变化如图所示;已知:A、C点对应的横坐标数据分别是500mL和2500mL,则
将M克钠和铝的混合物投入到一定量的水中,金属全部溶解,并收集到标准状况下体积为N升的气体,在所得溶液中逐滴加入1mol/L H2SO4,所得沉淀的物质的量随滴入硫酸溶液的体积变化如图所示;已知:A、C点对应的横坐标数据分别是500mL和2500mL,则