题目内容
17.碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造.CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究.【沉淀制备】
称取12.5 g胆矾溶于87.4 mL蒸馏水中,滴4滴稀硫酸,充分搅拌后得到CuSO4溶液.向其中加入适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤.
(1)滴加稀硫酸的作用是抑制Cu2+水解,防止溶液变浑浊.所得硫酸铜溶液的溶质质量分数为8.0%.
(2)用无水乙醇洗涤的目的是利用乙醇易挥发的性质带走沉淀上面的水.
【实验探究】
同学们设计了如图装置,用制得的蓝绿色固体进行实验:
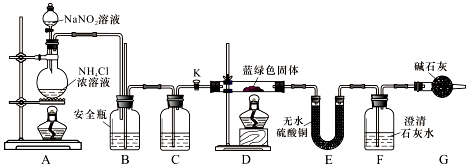
(3)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯.A中产生N2的作用是排除装置中的空气,避免干扰,C中盛装的试剂应是浓硫酸.
(4)装置A中发生反应的离子方程式为NO2-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O .
(5)若蓝绿色固体的组成为xCuCO3•yCu(OH)2,实验能观察到的现象是硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊 .
(6)同学们查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是bd.
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是 让停留在装置中的气体被充分吸收,减小实验误差 .若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g.则该蓝绿色固体的化学式为2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2.
分析 (1)铜离子水解,加酸抑制其水解,根据溶质质量分数=$\frac{溶质的质量}{溶液的质量}×100%$计算;
(2)乙醇易挥发,可带走水;
(3)通入N2的目的是排除装置中的空气;C瓶干燥气体;
(4)A中的反应为亚硝酸根与铵根离子价态归中生成氮气;
(5)蓝绿色固体的组成为xCuCO3•yCu(OH)2,则分解生成氧化铜、水、二氧化碳;
(6)Ca(OH)2为微溶物,溶解度比Ba(OH)2小,Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,均为难溶物,且溶解度相差不大,据此分析; 待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是让停留在装置中的气体被充分吸收,减小实验误差;E中吸收的是水,F中吸收的是二氧化碳,根据质量守恒定律测得氧化铜的质量,根据原子守恒确定其化学式.
解答 解:(1)铜离子水解,加酸抑制其水解;
12.5 g胆矾中含有硫酸铜的质量为12.5×$\frac{160}{160+90}×100%$=8g,
87.4 mL蒸馏水的质量为87.4g,则溶液的质量为12.5g+87.4g=99.9g,
所得硫酸铜溶液的溶质质量分数为$\frac{8g}{99.9g}×100%$=8%;
故答案为:抑制Cu2+水解,防止溶液变浑浊;8.0%;
(2)乙醇易挥发,可带走沉淀上面的水;
故答案为:利用乙醇易挥发的性质带走沉淀上面的水;
(3)通入N2的目的是排除装置中的空气,C瓶装浓硫酸干燥氮气;
故答案为:排除装置中的空气,避免干扰;浓硫酸;
(4)A中的反应为亚硝酸根与铵根离子价态归中生成氮气,发生的离子方程式为:
NO2-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
故答案为:NO2-+NH4+$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O;
(5)若蓝绿色固体的组成为xCuCO3•yCu(OH)2,则分解生成黑色氧化铜、水、二氧化碳,则硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊;
故答案为:硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊;
(6)Ba(OH)2溶解度大于Ca(OH)2,充分吸收CO2,BaCO3的摩尔质量大于CaCO3,测量误差小;氢氧化钙为强碱,CaCO3的溶解度和BaCO3溶解度相差不大;
待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是让停留在装置中的气体被充分吸收,减小实验误差;
E中吸收的是水,水的物质的量为$\frac{2.7g}{18g/mol}$=0.15mol,F中吸收的是二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒得二氧化碳的物质的量为$\frac{19.7g}{197g/mol}$=0.1mol,氧化铜的物质的量=(271.g-2.7g-0.1mol×44g/mol)÷80g/mol═0.25mol,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25mol:0.3mol:0.1mol=5:6:2,所以其化学式为:2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2;
故答案为:b d;让停留在装置中的气体被充分吸收,减小实验误差;2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2.
点评 本题考查了探究物质的组成和含量的测定,明确物质性质是解答关键,难点是化学式的确定,题目难度中等.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | 露置在空气中,容器内酸液的质量都减轻 | |
| B. | 常温下都能与铜较快反应 | |
| C. | 常温下都能与氨气反应 | |
| D. | 加热条件下都能与碳反应 |
| A. | A元素形成的双原子分子A2最多有3种 | |
| B. | 化合物BC2的电子式为 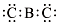 | |
| C. | B、C、D三种元素的非金属性强弱顺序为C>D>B | |
| D. | 化合物A2C的沸点高于A2D是因为C-A键比D-A键稳定 |
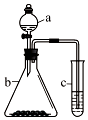 利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )
利用如图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是( )| 选项 | a | b | c | c试管中现象 |
| A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
| B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
| C | 硼酸 | Na2CO3 | Na2SiO3溶液 | 析出白色沉淀 |
| D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 原子总数是4NA的N2与CO混合物,其质量是56g | |
| C. | Na2O2和KMnO4分别制得1molO2,转移的电子数均是2NA | |
| D. | 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA |
| A. | 铜丝能导电,因此它是电解质 | |
| B. | BaSO4难溶于水,因此它是非电解质 | |
| C. | NaC1熔融状态时能导电,因此它是电解质 | |
| D. | 胶体区别于其他分散系的本质是具有丁达尔效应 |
| A. | 0.05mol/L 的 H2SO4溶液 PH=1 | |
| B. | 0.001mol/L 的 NaOH溶液 PH=11 | |
| C. | 0.005mol/L的H2SO4溶液与0.0lmol/LNaOH溶液等体积浪合,混合液pH=6,溶液呈酸性 | |
| D. | 完全中和PH=3的H2SO4溶液50mL,需要pH=11的NaOH溶液50mL |
