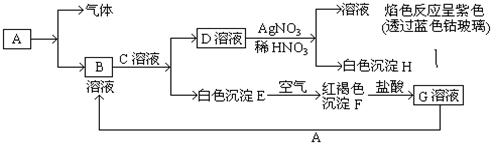
题目内容
请用化学方法除去下列物质中的杂质,写出除杂的离子方程式:
(1)除硫酸锌溶液中少量的硫酸亚铁:
(2)除镁中少量的铝:
(1)除硫酸锌溶液中少量的硫酸亚铁:
(2)除镁中少量的铝:
考点:物质的分离、提纯的基本方法选择与应用,离子方程式的书写
专题:离子反应专题,元素及其化合物
分析:(1)可加入锌除杂,锌与硫酸亚铁反应生成生成硫酸锌和铁;
(2)铝可与氢氧化钠溶液反应而除去.
(2)铝可与氢氧化钠溶液反应而除去.
解答:
解:(1)可加入锌除杂,锌与硫酸亚铁反应生成生成硫酸锌和铁,发生Zn+Fe2+=Zn2++Fe,故答案为:Zn+Fe2+=Zn2++Fe;
(2)Al与NaOH溶液反应,而Mg不能,选NaOH溶液来除杂,发生离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑.
(2)Al与NaOH溶液反应,而Mg不能,选NaOH溶液来除杂,发生离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑.
点评:本题考查除杂及离子反应方程式的书写,为高考常见题型,注意除杂的原则及物质的性质即可解答,侧重氧化还原反应的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列离子方程式正确的是( )
| A、碳酸钙和醋酸 CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
| B、碳酸氢钙溶液和足量氢氧化钠溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O | ||||
| C、铜和稀硝酸反应 Cu+4H++NO3?═Cu2++NO↑+2H2O | ||||
D、硫酸铵溶液和氢氧化钠溶液共热 NH4++OH-
|
设NA为阿伏加德罗常数,下面叙述正确的是( )
| A、标准状况下,11.2L SO3所含分子数为0.5 NA |
| B、1L 1mol/L的氯化钠溶液中,所含离子数为NA |
| C、64g二氧化硫含有原子数为3NA |
| D、在反应中,1mol镁转化为Mg2+后失去的电子数为NA |

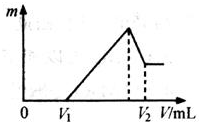 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: