题目内容
3.下列有关气体摩尔体积的描述中正确的是( )| A. | 气体摩尔体积为22.4 L•mol-1 | |
| B. | 1 mol O2的质量是32 g,它所占的体积是22.4 L | |
| C. | 标准状况下,1 mol任何物质的体积均约为22.4 L | |
| D. | 标准状况下,6.02×1023个CO分子的体积约为22.4 L |
分析 A、气体摩尔体积的数值和所处的状态有关;
B、氧气所处的状态不明确‘
C、气体摩尔体积只适用于气体;
D、求出CO的物质的量,然后根据体积V=nVm来计算.
解答 解:A、气体摩尔体积的数值和所处的状态有关,故数值不一定是22.4L/mol,故A错误;
B、氧气所处的状态不明确,故1mol氧气所占的体积不一定是22.4L,故B错误;
C、气体摩尔体积只适用于气体,故标况下只有1mol气体的体积才是22.4L,故C错误;
D、6.02×1023个CO分子的CO的物质的量为1mol,故体积V=nVm=1mol×22.4L/mol=22.4L,故D正确.
故选D.
点评 本题考查了气体摩尔体积的数值和有关计算,应注意的是气体摩尔体积的数值有无数个,和所处的状态有关,且只适用于气体.

练习册系列答案
相关题目
13.已知:
①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)=2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | N2的燃烧热为180 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1molN2和3molH2,反应后放出的热量为Q1kJ,则Q1=92.4 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906 kJ•mol-1 |
14.设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 mol Al3+离子含有的核外电子数为3NA | |
| B. | 常温常压下,22.4 L乙烯中C-H键数为4NA | |
| C. | 10 L pH=1的硫酸溶液中含有的H+离子数为2NA | |
| D. | 18gH2O中含有的质子数为10NA |
11.乙酸香兰酯是用于调配奶油、冰淇淋的食用香精,其合成反应的化学方程式如下:

下列叙述错误的是( )

下列叙述错误的是( )
| A. | 该反应属于取代反应 | |
| B. | FeCl3溶液可用于区别香兰素与乙酸香兰酯 | |
| C. | 乙酸香兰酯的分子式为C10H12O4 | |
| D. | 乙酸香兰酯在足量NaOH溶液中水解得到乙酸钠和香兰素的钠盐 |
18.有Na2SO4、Fe2(SO4)3的混合溶液,已知其中Fe3+的物质的量浓度为0.3mol•L-1,SO42-的物质的量浓度为0.6mol•L-1,则此溶液中Na+的物质的量浓度为( )
| A. | 0.1 mol•L-1 | B. | 0.3 mol•L-1 | C. | 0.2 mol•L-1 | D. | 0.25 mol•L-1 |
8.体积为VmL,密度为d g/mL,溶质的摩尔质量为M g•mol-1,物质的量浓度为c mol•L-1,溶质的质量分数为a%,溶质的质量为m g.下列式子正确的是( )
| A. | m=aVd | B. | a%=(cM/1 0d)% | C. | c=1 000mVM | D. | c=1 000daM |
12.选择萃取剂将碘水中的碘萃取出来,这种萃取剂不可能是( )
| A. | 苯 | B. | 四氯化碳 | C. | 酒精 | D. | 汽油 |
9.下列说法正确的是( )
| A. | 按系统命名法 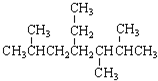 ,的名称为2,5,6-三甲基-4-乙基庚烷 ,的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖 | |
| D. | 苯酚为无色晶体,常因为氧化呈粉红色 |