题目内容
5. 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为:I.将C12 通入石灰浆,充分反应后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KCIO3固体.
请回答下列问题:
步骤I中总反应的化学方程式为6Ca(OH)2+6Cl2=Ca(ClO)2+5CaCl2+6H2O.
(1)①标出反应中电子转移的方向和数目
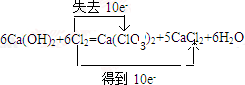 .
.②滤液中Ca(ClO3)2与CaC12的物质的量之比n:n<l:5 (填“>”、“<”或“=”),理由是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(2)如图是有关物质的溶解度曲线.步骤II中,若溶液中KCIO3的含量为100g•L-1,从该溶液中尽可能多地析出KClO3 固体的方法是蒸发浓缩、冷却结晶.
分析 (1)①根据化合价升降判断氧化剂和还原剂,结合化学计量数得出得失电子总数,反应6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O中只有Cl元素化合价发生变化,由0价分别变化为+5价、-1价;
②部分氯气与冷的氢氧化钙反应生成氯化钙、次氯酸钙和水;
(2)经蒸发浓缩、冷却结晶可得晶体KClO3.
解答 解:(1)①反应6Cl2+6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O中只有Cl元素化合价发生变化,由0价分别变化为+5价、-1价,氯气既是氧化剂也是还原剂,由方程式可知反应6mol氯气时生成1molCa(ClO3)2,转移10mol电子,
Cl:0→-1,↓1,×5
Cl:0→+5,↑5,×1 
故答案为: ;
;
②部分氯气与冷的氢氧化钙反应2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,也生成氯化钙,所以n(Ca(ClO3)2):n(CaCl2)<l:5,
故答案为:<;同时还发生反应2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)该溶液中尽可能多地析出KClO3固体,应经蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩、冷却结晶.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析能力的考查,解答本题注意把握物质的性质以及题给信息,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.离子方程式CO32-+2H+=CO2↑+H2O可表示的反应是( )
| A. | 石灰石和盐酸 | B. | 碳酸氢铵和盐酸 | C. | 碳酸钾和醋酸 | D. | 碳酸钠和硫酸 |
10.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,C12 可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙二酸可与高锰酸钾溶液发生反应 | |
| C. | 乙醇和乙烯的混合物 lmol,完全燃烧消耗 3molO2 | |
| D. | 光照下 2,2-二甲基丁烷与 Br2 反应,其一溴取代物只有 2 种 |
14.常温下,下列有关叙述错误的是( )
| A. | 滴有酚酞的氨水中加入少量NH4Cl固体,溶液颜色变浅 | |
| B. | 等浓度的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 向pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则体积V(HA)≤V(NaOH) | |
| D. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 |


 ,随意丢弃聚氯乙烯制品会造成白色污染.
,随意丢弃聚氯乙烯制品会造成白色污染. ,该反应中反应物溴应该选用液溴(填“溴水”或“液溴”).
,该反应中反应物溴应该选用液溴(填“溴水”或“液溴”).
 .
. E的合成路线如下:
E的合成路线如下:
 .X→Y的反应类型是消去反应.
.X→Y的反应类型是消去反应. $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ )为原料合成苯乙醛,设计合成路线:
)为原料合成苯乙醛,设计合成路线: $\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$
$\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$ $\stackrel{Cu/△}{→}$
$\stackrel{Cu/△}{→}$ .
.
 ;溶液II中存在的阴离子为OH-、Cl-.
;溶液II中存在的阴离子为OH-、Cl-.