题目内容
14.常温下,下列有关叙述错误的是( )| A. | 滴有酚酞的氨水中加入少量NH4Cl固体,溶液颜色变浅 | |
| B. | 等浓度的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 向pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则体积V(HA)≤V(NaOH) | |
| D. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 |
分析 A、从加入少量的NH4Cl晶体后氨水的电离平衡移动方向进行判断;
B、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O,根据电荷守恒判断;
C、分别根据HA为强酸和弱酸进行讨论;
D、相同温度、浓度下,酸的电离平衡常数越大,酸的酸性越强,其酸根离子的水解能力越小,结合强酸制取弱酸分析解答.
解答 解:A、因氨水电离生成氢氧根离子,则酚酞遇碱变红,当加入少量的NH4Cl晶体后,NH4+离子浓度增大,根据同离子效应,加入NH4Cl后,氨水的电离平衡向逆方向移动,抑制氨水电离,从而c(OH-)变小,颜色变浅,故A正确;
B、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO32-+H2O,等浓度的小苏打溶液与烧碱溶液等体积混合后得到的是碳酸钠溶液,存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故B正确;
C、向 pH=12的NaOH溶液中滴加pH=2的HA溶液达中性,当HA为弱酸时,则HA的浓度大于NaOH,滴入HA溶液时恰好为中性,则酸的体积比碱的体积小点,若HA为强酸,则HA的浓度等于NaOH,溶液为中性时,滴入的HA溶液体积相等,则体积V(HA)≤V(NaOH),故C正确;
D、酸性H2CO3>HCN>HCO3-,所以氢氰酸加入到碳酸钠溶液中,没有气体生成,故D错误.
故选D.
点评 本题考查了弱电解质的电离,明确酸的电离平衡常数与酸性强弱、离子浓度大小关系是解本题关键,难度中等.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
9.下列对有机物结构或性质的描述,错误的是( )
| A. | 2-甲基丙烷的所有碳原子可能处于同一平面 | |
| B. | 一定条件下,Cl2可在甲苯( )的苯环或侧链上发生取代反应 )的苯环或侧链上发生取代反应 | |
| C. | 乙烷和丙烯(C3H6)的物质的量各1mol,完全燃烧都是生成3mol H2O | |
| D. | 光照下2,2-二甲基丙烷与Cl2反应其一氯代物只有一种 |
19.下列关于化学键的叙述正确的是( )
| A. | 化学键既存在于相邻原子之间,也存在于相邻分子之间 | |
| B. | 两个原子之间的相互作用叫化学键 | |
| C. | 化学键通常指的是直接相邻的原子或离子之间的强烈的相互作用 | |
| D. | 离子键是阴、阳离子通过静电引力而形成的化学键 |
6.下列关于生铁和钢的叙述正确的是( )
| A. | 由铁矿石炼成铁是化学变化,由生铁炼成钢是物理变化 | |
| B. | 生铁、钢的硬度都比纯铁的大 | |
| C. | 生铁和钢都含有铁元素,它们的性能和用途相差不大 | |
| D. | 生铁可以完全溶解在足量稀盐酸中 |

 ;反应类型:加聚反应
;反应类型:加聚反应 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为: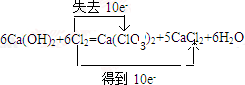 .
. 如图装置中甲烧杯盛放100mL 0.2mol/L 的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入AC (填序号).
如图装置中甲烧杯盛放100mL 0.2mol/L 的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入AC (填序号).