题目内容
 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:(1)该反应的化学方程式为:
(2)反应开始至2min末,X的反应速率为
(3)该反应是由
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据反应中浓度的变化写出化学方程式;
(2)根据2min内X浓度的变化计算得出;
(3)根据平衡开始时,各物质的物质的量判断.
(2)根据2min内X浓度的变化计算得出;
(3)根据平衡开始时,各物质的物质的量判断.
解答:
解:(1)根据图象可知Y、Z浓度降低,为反应物,X浓度增大为生成物,当物质的量不再变化时,达到平衡状态,此时△n(Y)=1.2mol-1.0mol=0.2mol,△n(Z)=2.0mol-1.6mol=0.4mol,△n(X)=1.0mol-0.4mol=0.6mol,计量数之比等于△n(Y):△n(Z):△n(X)=1:2:3,化学方程式可写为Y+2Z?3X,
故答案为:Y+2Z?3X;
(2)反应开始至2min末,△n(X)=0.8mol-0.4mol=0.2mol,△c(X)=
=0.1mol/L,化学反应速率为
=0.1mol/(L?min),
故答案为:0.1mol/(L?min);
(3)反应刚开始时,反应物和生成物物质的量均不为零,即化学平衡是由正、逆反应同时开始反应的,
故答案为:开始反应的.
故答案为:Y+2Z?3X;
(2)反应开始至2min末,△n(X)=0.8mol-0.4mol=0.2mol,△c(X)=
| 0.2mol |
| 2L |
| 0.1mol/L |
| 2min |
故答案为:0.1mol/(L?min);
(3)反应刚开始时,反应物和生成物物质的量均不为零,即化学平衡是由正、逆反应同时开始反应的,
故答案为:开始反应的.
点评:本题考查化学平衡的变化图象,题目难度不大,本题注意化学方程式的确定方法,以及反应速率计算,把握好相关概念和公式的理解及运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、CO、CO2组成元素相同,都能将Fe2O3还原成Fe |
| B、SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐 |
| C、Na2O、Na2O2为相同元素组成的金属氧化物,与 CO2反应产物相同 |
| D、浓硫酸、浓硝酸、稀硝酸均具有强氧化性,常温下均可用铝制容器盛放 |
下列实验装置不适用于物质分离的是( )
A、 |
B、 |
C、 |
D、 |
下列装置能够组成原电池的是( )
A、 稀H2SO4 |
B、 AgNO3(aq) |
C、 酒精 |
D、 稀H2SO4 稀H2SO4 |
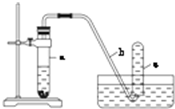 用如图所示的装置进行实验:
用如图所示的装置进行实验: 取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL.
取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL.