题目内容
下列实验能达到目的是( )
A、 除去乙烷中的乙烯 |
B、 制取蒸馏水 |
C、 乙醇催化氧化 |
D、 CO2喷泉实验 |
考点:化学实验方案的评价,乙醇的化学性质,蒸馏与分馏
专题:实验评价题
分析:A.乙烯易被酸性高锰酸钾溶液氧化生成二氧化碳;
B.蒸馏时,温度计测量蒸气温度;
C.在加热条件下,乙醇能被Cu催化氧化生成乙醛;
D.极易溶于该溶液的气体能发生喷泉实验.
B.蒸馏时,温度计测量蒸气温度;
C.在加热条件下,乙醇能被Cu催化氧化生成乙醛;
D.极易溶于该溶液的气体能发生喷泉实验.
解答:
解:A.乙烯易被酸性高锰酸钾溶液氧化生成二氧化碳,从而引进新的杂质,所以不能用酸性高锰酸钾溶液除去乙烷中的乙烯,可以用溴的四氯化碳溶液作除杂剂,故A错误;
B.蒸馏时,温度计测量蒸气温度而不是溶液温度,所以温度计水银球位于支管口处,故B错误;
C.在加热条件下,乙醇能被Cu催化氧化生成有刺激性气味的乙醛,故C正确;
D.极易溶于该溶液的气体能发生喷泉实验,二氧化碳在水溶液中的溶解度较小,所以不能形成喷泉实验,故D错误;
故选C.
B.蒸馏时,温度计测量蒸气温度而不是溶液温度,所以温度计水银球位于支管口处,故B错误;
C.在加热条件下,乙醇能被Cu催化氧化生成有刺激性气味的乙醛,故C正确;
D.极易溶于该溶液的气体能发生喷泉实验,二氧化碳在水溶液中的溶解度较小,所以不能形成喷泉实验,故D错误;
故选C.
点评:本题考查了实验方案评价,明确实验原理是解本题关键,根据物质的性质分析解答,知道形成喷泉实验的条件、除杂原则等知识点,题目难度中等.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
已知阿伏加德罗常数为NA,下列说法正确的是( )
| A、1mol钠与足量氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
| B、1mol Na2O2与足量CO2反应时,转移2NA个电子 |
| C、1mol/L的NaOH溶液中含Na+数目NA |
| D、1mol Na2O2晶体中含有的阴离子数目为2NA |
用图所示装置进行实验,不能达到实验目的是( )
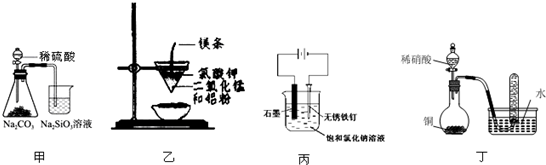

| A、用甲装置比较硫、碳、硅三种元素的非金属性强弱 |
| B、用乙装置可制得金属锰,用同样的装置可制得金属铬 |
| C、用丙装置可实现对铁钉的保护 |
| D、用丁装置验证铜与稀硝酸反应的气体产物只有NO |
已知KClO3与浓HCl反应的化学方程式为:KClO3+6HCl═KCl+3C12+3H2O,若用K35ClO3与H37Cl作用,则下列说法正确的是( )
| A、所得氯气的相对分子质量约为71 |
| B、KCl中只含35Cl |
| C、所得的KCl中既含35Cl又含37Cl |
| D、被氧化和被还原的氯原子数之比为5:1 |
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是( )


| A、①是其他条件一定时,反应速率随温度变化的图象,正反应△H<0 |
| B、②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 |
| C、③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线 |
| D、④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
已知:强酸和强碱在稀溶液中发生反应时的中和热为-57.3kJ?mol-1,101kPa时辛烷的燃烧热为5518kJ?mol-1.则下列热化学方程式书写正确的是( )
| A、H++OH-═H2O△H=-57.3 kJ?mol-1 |
| B、2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ?mol-1 |
| C、2C8H18(l)+25O2(g)═16CO2(g)+18H2O(g)△H=-11036 kJ?mol-1 |
| D、2C8H18(l)+25O2(g)═16CO2(g))+18H2O(l)△H=-5518kJ?mol-1 |
下列说法正确的是( )
| A、从明矾是常用的净水剂可推测凡含有铝元素的物质都有净水作用 |
| B、不同物质各有其特性,明矾可用做净水剂,Al2(SO4)3就不一定有净水作用 |
| C、净水剂就是指能杀灭水中细菌和有害微生物的化学试剂 |
| D、从理论上说,铝盐和铁盐都可用做净水剂 |
 我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.
我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.