题目内容
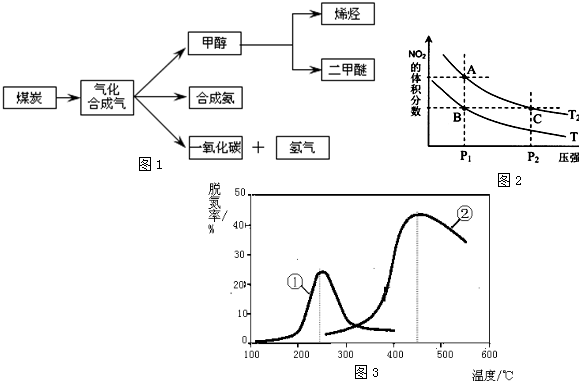
如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为 .
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g)?2CO(g),K1
CO(g)+H2O(g)?H2(g)+CO2(g),K2
C(s)+H2O(g)?CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 .
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
该反应的逆反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为 .
(3)对于反应N2O4(g)?2NO2(g)-Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是 .
A.两种不同的温度比较:T1>T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如图3,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)以下说法正确的是 (注:脱氮率即氮氧化物转化率)
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮.

(1)已知该产业链中某反应的平衡表达式为:K=
| [H2][CO] |
| [H2O] |
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g)?2CO(g),K1
CO(g)+H2O(g)?H2(g)+CO2(g),K2
C(s)+H2O(g)?CO(g)+H2(g),K3
则K1、K2、K3之间的关系为
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(3)对于反应N2O4(g)?2NO2(g)-Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是
A.两种不同的温度比较:T1>T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如图3,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)以下说法正确的是
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮.
考点:化学平衡的影响因素,热化学方程式,化学平衡建立的过程,化学平衡的计算
专题:基本概念与基本理论
分析:(1)根据平衡常数的定义判断反应的方程式,根据平衡常数的表达式推断;
(2)依据图表数据分析,平衡常数随温度升高减小,平衡逆向进行,正反应为放热反应,逆反应为吸热反应;结合化学平衡三段式列式计算平衡浓度;
(3)从平衡移动的角度分析各物理量的变化;
(4)A.温度升高脱氨率降低,说明平衡向逆反应方向移动;
B.增大压强平衡向逆反应方向移动;
C.最高点为催化剂活性最高的温度;
D.根据图象判断,脱氨率最高的点对应的温度应是最适宜温度;
(2)依据图表数据分析,平衡常数随温度升高减小,平衡逆向进行,正反应为放热反应,逆反应为吸热反应;结合化学平衡三段式列式计算平衡浓度;
(3)从平衡移动的角度分析各物理量的变化;
(4)A.温度升高脱氨率降低,说明平衡向逆反应方向移动;
B.增大压强平衡向逆反应方向移动;
C.最高点为催化剂活性最高的温度;
D.根据图象判断,脱氨率最高的点对应的温度应是最适宜温度;
解答:
解:(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,所以该反应的方程式为C(s)+H2O(g)?CO(g)+H2(g),故答案为:C(s)+H2O(g)?CO(g)+H2(g);
根据化学方程式可知:K1=
,K2=
,K3=
,所以:K3=K1×K;
故答案为:K3=K1×K2;
(2)依据图表数据分析,平衡常数随温度升高减小,平衡逆向进行,正反应为放热反应,逆向反应为吸热反应;结合化学平衡三段式列式计算平衡浓度,设一氧化碳转化率x;
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 0.02 0.02 0 0
变化量(mol/L) 0.02x 0.02x 0.02x 0.02x
平衡量(mol/L)0.02-0.02x 0.02-0.02x 0.02x 0.02x
=9
x=75%
故答案为:吸热,75%;
(3)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.则
A.压强不变,反应是吸热反应,温度升高,平衡向正反应移动,二氧化氮体积分数增大,所以T1<T2,故A错误;
B.A点压强小于C点的压强,压强越大,反应速率越大,则反应速率:A<C,故B正确;
C.B、C两点二氧化氮的体积分数相同,则混合气体的平均相对分子质量相同,故C错误;
D.在相同压强下,升高温度,平衡向逆反应方向移动,则二氧化氮的体积分数增大,所以由状态B到状态A,可以用加热的方法,故D正确;
故答案为:BD;
(4)A.脱氨率达到最高点之后继续升高温度,脱氨率降低,说明平衡向逆反应方向移动,则正反应为放热反应,故A错误;
B.反应为体积增大的反应,增大压强平衡向逆反应方向移动,故B错误.
C.图象研究的是不同催化剂在不同的温度下的活性比较,最高点为催化剂活性最大的状态,与平衡转化率无关,故C错误;
D.两种催化剂分别在250℃和450℃左右催化效率最高,说明此时催化剂的活性最大,故D正确;
故选:D.
根据化学方程式可知:K1=
| c2(CO) |
| c(CO2) |
| c(H2)c(CO2) |
| c(CO)c(H2O) |
| c(CO)×c(H2) |
| c(H2O) |
故答案为:K3=K1×K2;
(2)依据图表数据分析,平衡常数随温度升高减小,平衡逆向进行,正反应为放热反应,逆向反应为吸热反应;结合化学平衡三段式列式计算平衡浓度,设一氧化碳转化率x;
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol/L) 0.02 0.02 0 0
变化量(mol/L) 0.02x 0.02x 0.02x 0.02x
平衡量(mol/L)0.02-0.02x 0.02-0.02x 0.02x 0.02x
| (0.02x)2 |
| (0.02-0.02x)2 |
x=75%
故答案为:吸热,75%;
(3)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.则
A.压强不变,反应是吸热反应,温度升高,平衡向正反应移动,二氧化氮体积分数增大,所以T1<T2,故A错误;
B.A点压强小于C点的压强,压强越大,反应速率越大,则反应速率:A<C,故B正确;
C.B、C两点二氧化氮的体积分数相同,则混合气体的平均相对分子质量相同,故C错误;
D.在相同压强下,升高温度,平衡向逆反应方向移动,则二氧化氮的体积分数增大,所以由状态B到状态A,可以用加热的方法,故D正确;
故答案为:BD;
(4)A.脱氨率达到最高点之后继续升高温度,脱氨率降低,说明平衡向逆反应方向移动,则正反应为放热反应,故A错误;
B.反应为体积增大的反应,增大压强平衡向逆反应方向移动,故B错误.
C.图象研究的是不同催化剂在不同的温度下的活性比较,最高点为催化剂活性最大的状态,与平衡转化率无关,故C错误;
D.两种催化剂分别在250℃和450℃左右催化效率最高,说明此时催化剂的活性最大,故D正确;
故选:D.
点评:本题考查化学反应速率与化学平衡移动问题,化学平衡常数及影响因素、意义,反应速率计算等,难度中等,本题注意分析图象曲线的变化趋势.

练习册系列答案
相关题目
关于电解氯化钠溶液,下列叙述正确的是 ( )
| A、原电池的正极和电解池的阴极所发生的反应类型相同 |
| B、若在阳极附近的溶液中滴入KI淀粉试液,溶液呈蓝色 |
| C、若在阴极附近的溶液中滴入酚酞试液,溶液仍无色 |
| D、电解一段时间后,将全部电解液转移到烧杯中,加入适量盐酸充分搅拌后溶液可恢复原状况 |
下列物质中,属于酸性氧化物但不溶于水的是( )
| A、CO2 |
| B、SiO2 |
| C、SO2 |
| D、Fe2O3 |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、100mL0.1mol/L K2SO4 溶液中,含有氧原子数为0.04NA |
| B、100g 17%的氨水中,含有氨分子的数为NA |
| C、1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数NA |
| D、25℃时,1.0L pH=13的Ba(OH)2溶液中,含有0.2NA OH- |
 表示的分子式
表示的分子式 中含有的官能团的名称为
中含有的官能团的名称为 )在一定条件下以等物质的量缩聚而成,则Nomex的结构简式为( )
)在一定条件下以等物质的量缩聚而成,则Nomex的结构简式为( )


