题目内容
1. 某实验小组拟用铜片、锌片、CuCl2溶液、ZnCl2溶液等设计原电池.并将装置图画到了如图所示程度.
某实验小组拟用铜片、锌片、CuCl2溶液、ZnCl2溶液等设计原电池.并将装置图画到了如图所示程度.(1)通过增加仪器对图进行必要的补充,以完善原电池装置(在原图上作答)
(2)写出负极反应式:Zn-2e-=Zn2+
(3)若用上述原电池和惰性电极电解CuCl2溶液,电解池的阳极应连接铜片(填写“铜片”或“锌片”),电解CuCl2溶液的离子方程式为CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑.
分析 (1)根据原电池的构成的条件进行回答;
(2)原电池的负极上发生失电子的氧化反应,据此回答;
(3)电解池的阳极应连接原电池的正极,电解氯化铜得到金属铜和氯气,据此回答.
解答 解:(1)原电池必须是闭合的回路、自发氧化还原反应、两个电极;电解质溶液,所以可以在该装置中加上盐桥,故答案为: ;
;
(2)原电池的负极上发生失电子的氧化反应,根据装置得到金属锌是负极,电极反应式为Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(3)电解池的阳极应连接原电池的正极,即和金属铜连接,电解氯化铜得到金属铜和氯气,即CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑,故答案为:铜片;CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑.
点评 本题考查学生原电池和电解池的工作原理知识,属于综合知识的考查,难度中等.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
11.X、Y、Z和R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同(a、b、c、d为元素的核电荷数),则下列关系正确的是( )
| A. | a-c=m-n | B. | a-b=n-m | C. | c-d=m+n | D. | b-d=m+n |
9.下列说法中正确的是(NA为阿伏加德罗常数的值)( )
| A. | 1mol苯分子中所含的C=C键数为3NA | |
| B. | 60gSiO2中含有Si-O键的个数为2NA | |
| C. | 0.1molCnH2n+2中含有的碳碳单键数为0.1nNA | |
| D. | 18 g冰中含氢键的个数为2NA |
16.有机物的结构简式为  可发生反应类型的组合是( )
可发生反应类型的组合是( )
①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚.
 可发生反应类型的组合是( )
可发生反应类型的组合是( )①取代 ②加成 ③消去 ④水解 ⑤酯化 ⑥中和 ⑦氧化 ⑧加聚.
| A. | 只有①②③⑤⑥⑦ | B. | 只有②③④⑥⑧ | C. | 只有①②③⑤⑥ | D. | 只有③④⑤⑥⑦⑧ |
6.将100mL质量分数为14%的Ba(OH)2溶液的物质的量浓度稀释至原来的一半,下列稀释方法正确的是( )
| A. | 往原溶液中加100mL水 | B. | 再加100mL原溶液 | ||
| C. | 将原溶液稀释为200mL | D. | 加入等浓度等体积的硫酸 |
13.若NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1 L l mol•L-1 Na2CO3溶液中,阴离子总数大于0.1NA | |
| B. | 标准状况下,22.4 L氦气中含有的原子数为2NA | |
| C. | 100 g 98%的浓硫酸中,氧原子总数为4NA | |
| D. | 4.6 g组成为C2H6O的有机物,C-H键数目不一定为0.5NA |
10.关于苯,下列说法正确的是( )
| A. | 苯不溶于水,密度比水大 | |
| B. | 苯不能发生氧化反应 | |
| C. | 除去苯中混有的少量甲苯,可以用酸性高锰酸钾溶液 | |
| D. | 苯可以跟溴水反应制取溴苯 |
11.【探究一:该白色固体的成分】
“滴水生火”魔术是用胶头滴管将水滴到包裹淡黄色固体过氧化钠的棉花上,棉花燃烧起来,淡黄色固体完全变为白色固体.滴水时发生反应:2Na2O2+2H2O﹦4NaOH+O2↑
某兴趣小组对该白色固体的成分及含量进行探究.
探究一:该白色固体的成分
猜想Ⅰ:该白色固体为氢氧化钠
猜想Ⅱ:该白色固体为碳酸钠
猜想Ⅲ:该白色固体为氢氧化钠与碳酸钠的混合物
(1)经分析,上述猜测Ⅰ不合理.
(2)为确定该白色固体的成分,小明同学设计了如下实验方案,请你一起完成下列实验报告:(实验室可供选择的试剂有:氯化钡溶液、酚酞、澄清石灰水、稀盐酸)
“滴水生火”魔术是用胶头滴管将水滴到包裹淡黄色固体过氧化钠的棉花上,棉花燃烧起来,淡黄色固体完全变为白色固体.滴水时发生反应:2Na2O2+2H2O﹦4NaOH+O2↑
某兴趣小组对该白色固体的成分及含量进行探究.
探究一:该白色固体的成分
猜想Ⅰ:该白色固体为氢氧化钠
猜想Ⅱ:该白色固体为碳酸钠
猜想Ⅲ:该白色固体为氢氧化钠与碳酸钠的混合物
(1)经分析,上述猜测Ⅰ不合理.
(2)为确定该白色固体的成分,小明同学设计了如下实验方案,请你一起完成下列实验报告:(实验室可供选择的试剂有:氯化钡溶液、酚酞、澄清石灰水、稀盐酸)
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品溶于水,加入过量的氯化钡溶液; | 白色沉淀产生 | 该反应的化学方程式:Na2CO3+BaCl2═BaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液加入酚酞试液. | 溶液变红色 | 证明猜想Ⅲ成立 |


 ;F
;F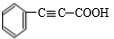 .
. +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$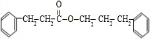 +H2O.
+H2O.