题目内容
2.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出).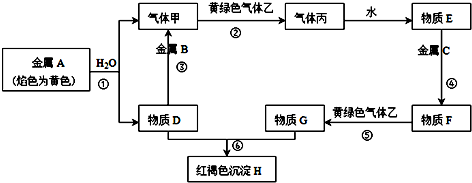
请回答下列问题:
(1)写出下列物质的电子式:丙
 、D
、D .
.(2)写出下列反应的离子反应方程式:
反应①2Na+2H2O=2Na++2OH-+H2↑;
反应⑤Cl2+2Fe2+=2Fe3++2Cl-;
反应⑥Fe3++3OH-=Fe(OH)3↓.
分析 金属A颜色反应为黄色,则A为Na,钠与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应生成氢气,则B为Al;黄绿色气体乙为Cl2,氯气与氢气反应生成丙为HCl,溶于水得到E为盐酸,物质D(氢氧化钠)和G为反应生成红褐色沉淀H为Fe(OH)3,说明G中含有Fe3+,金属C与盐酸反应得到F,F与氯气反应得到G,可推知,C为Fe,F为FeCl2,G为FeCl3,据此进行解答.
解答 解:金属A颜色反应为黄色,则A为Na,钠与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应生成氢气,则B为Al;黄绿色气体乙为Cl2,氯气与氢气反应生成丙为HCl,溶于水得到E为盐酸,物质D(氢氧化钠)和G为反应生成红褐色沉淀H为Fe(OH)3,说明G中含有Fe3+,金属C与盐酸反应得到F,F与氯气反应得到G,可推知,C为Fe,F为FeCl2,G为FeCl3,
(1)丙为HCl,氯化氢为共价化合物,其电子式为 ;D为NaOH,NaOH为离子化合物,其电子式
;D为NaOH,NaOH为离子化合物,其电子式 ,
,
故答案为: ;
; ;
;
(2)反应①为钠与水的反应,其反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
反应⑤是氯化亚铁和氯气反应生成氯化铁的反应,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,
故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
反应⑥的化学方程式为:3NaOH+FeCl3=Fe(OH)3↓+3NaCl,离子方程式为:Fe3++3OH-=Fe(OH)3↓,
故答案为:Fe3++3OH-=Fe(OH)3↓.
点评 本题考查无机物的推断,题目难度中等,涉及中学常见金属与氯气的性质,A的焰色反应及物质I乙的颜色等是推断突破口,熟练掌握元素化合物性质,试题培养了学生的分析能力及逻辑推理能力.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH2OH ④CH2=CHCH2OH⑤
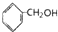
| A. | ①③ | B. | ①④⑤ | C. | ②④ | D. | ①②③⑤ |
| A. | 氨气可用排水法收集 | |
| B. | 氯化铵固体加热容易分解 | |
| C. | 氨气和酸相遇都能产生白烟 | |
| D. | 实验室用氢氧化钠溶液和氯化铵溶液加热制NH3 |
| A. | 常温下硅性质活泼,可以与氯气、强酸、强碱溶液等起反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
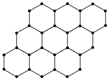 2010年诺贝尔物理学奖用于表彰首次剥离出单层石墨的科学家.单层石墨称为石墨烯,这种“只有一层碳原子厚的碳薄片”的石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,应用前景十分广阔!(结构示意图如图所示).下列关于石墨烯的叙述正确的是( )
2010年诺贝尔物理学奖用于表彰首次剥离出单层石墨的科学家.单层石墨称为石墨烯,这种“只有一层碳原子厚的碳薄片”的石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,应用前景十分广阔!(结构示意图如图所示).下列关于石墨烯的叙述正确的是( )| A. | 石墨烯可导电,说明它是电解质 | |
| B. | 石墨烯、金刚石、C60都是碳的单质 | |
| C. | 金刚石与石墨烯互为同位素 | |
| D. | ${\;}_{6}^{12}$C与${\;}_{6}^{13}$C为不同的核素,有不同的化学性质 |
| A. | 0.4 mol•(L•s)-1 | B. | 0.3 mol•(L•s)-1 | C. | 0.2 mol•(L•s)-1 | D. | 0.1 mol•(L•s)-1 |




 ,下列相关离子方程式或化学方程式错误的是
,下列相关离子方程式或化学方程式错误的是