题目内容
8.下列关于常温下电解质溶液的说法正确的是( )| A. | 0.1mol•L-1的HF溶液加水稀释过程中,HF的电离平衡常数逐渐增大 | |
| B. | pH=12的NaOH溶液与pH=2的醋酸溶液等体积混合后,溶液呈中性 | |
| C. | pH=5的NaHSO3溶液中水电离出的H+浓度小于10-71mol•L-1 | |
| D. | 向Na2CO3,Na2SO4的混合溶液中逐滴加入BaCl2溶液,一定先生成BaSO4 |
分析 A.电离平衡常数只受温度影响;
B.pH=12的NaOH溶液中氢氧化钠的浓度等于0.01mol/L,pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L;
C.氢离子抑制水的电离;
D.是否产生沉淀取决于物质的浓度和溶度积常数.
解答 解:A.电离平衡常数只受温度影响,所以0.1mol•L-1的HF溶液加水稀释过程中,HF的电离平衡常不变,故A错误;
B.pH=12的NaOH溶液中氢氧化钠的浓度等于0.01mol/L,pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L,二者等体积混合时,醋酸过量,溶液显酸性,故B错误;
C.pH=5的NaHSO3溶液,NaHSO3电离出的氢离子抑制水的电离,所以水电离出的H+浓度小于10-71mol•L-1,故C正确;
D.溶度积常数小、而且浓度大的,会先生成,由于Na2CO3和Na2SO4的浓度不知道,而且BaSO4和BaCO3的溶度积常数大小关系不知道,所以无法判断BaSO4和BaCO3谁先生成,故D错误.
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算、溶度积常数的应用,题目难度中等,注意掌握酸碱混合的定性判断方法,明确溶液酸碱性与溶液pH的关系为解答本题的根据.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.元素X、Y、Z位于不同短周期,原子序数依次增大.X、Z同主族,二者的原子序数之和是Y原子序数的两倍.主族元素W的原子最外层电子数比电子层数多4.下列说汰不正确的是( )
| A. | 简单离子半径:W>Z>X | |
| B. | X、Y、Z都能与W组成离子化合物 | |
| C. | X、Y组成的化合物可与W单质反应 | |
| D. | Q是Z、W组成的化合物,1molQ中约含有6.02×1023个阴离子 |
16.下列说法正确的是( )
| A. | 向某溶液中加入BaCl2溶液,产生白色沉淀,再加盐酸,沉淀不溶解,该溶液一定含有SO42- | |
| B. | 向某溶液中同时加入几滴KSCN溶液和少量新制氯水,溶液变为红色,该溶液一定含有Fe2+ | |
| C. | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体,该溶液不一定含有CO32- | |
| D. | 向某溶液中加入稀硝酸后,再加入AgNO3溶液,产生白色沉淀,则该溶液中含有Cl- |
13.对于某些离子的检验及结论中一定正确的是( )
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中大量含有CO32- | |
| B. | 加入稀盐酸和氯化钡溶液,有白色沉淀产生,则原溶液中一定含有SO42- | |
| C. | 分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 | |
| D. | 加硝酸银溶液后产生白色沉淀,再加盐酸,白色沉淀不消失,则原溶液中一定有Cl- |
20. 按如图装置进行实验,下列推断正确的是( )
按如图装置进行实验,下列推断正确的是( )
 按如图装置进行实验,下列推断正确的是( )
按如图装置进行实验,下列推断正确的是( )| 选项 | I中试剂 | II中试剂及现象 | 推断 |
| A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
| B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
| C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
| D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
| A. | A | B. | B | C. | C | D. | D |
17.向下列物质水溶液中通人过量的SO2后,最终既无沉淀也无气体产生的是( )
①H2S②NaHCO3③Na2SO3④Na2SiO3⑤Ba(NO3)2 ⑥Ca(OH)2 ⑦BaCl2.
①H2S②NaHCO3③Na2SO3④Na2SiO3⑤Ba(NO3)2 ⑥Ca(OH)2 ⑦BaCl2.
| A. | ①②④ | B. | ②③⑤ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
18.实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷,装置如图所示:
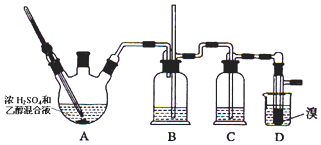
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
回答下列问题:
(1)写出三颈烧瓶A中发生反应的化学方程式CH3CH2OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(2)为了减少A装置中副反应的发生,操作时应注意迅速地把反应温度提高到170℃左右;
(3)B装置的作用为平衡气压,以获得较平稳的气流,防止倒吸,判断装置是否堵塞;
(4)在装置C中应加入NaOH溶液,除去反应中可能生成的某些杂质气体,防止对后续实验造成干扰;
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.

可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132[ | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)写出三颈烧瓶A中发生反应的化学方程式CH3CH2OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(2)为了减少A装置中副反应的发生,操作时应注意迅速地把反应温度提高到170℃左右;
(3)B装置的作用为平衡气压,以获得较平稳的气流,防止倒吸,判断装置是否堵塞;
(4)在装置C中应加入NaOH溶液,除去反应中可能生成的某些杂质气体,防止对后续实验造成干扰;
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.