题目内容
3.现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,层电子数相等,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数,A能分别与B、C形成电子总数都为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数都为18的气体分子.请回答下列问题(题中的字母只是元素代号,回答问题请用实际元素符号作答):(1)C在周期表中的位置为第二周期VIA族
(2)D、E、F形成的简单离子半径最大的是S2-
(3)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为
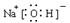 .
.(4)E、F分别形成的气态氢化物更稳定的是HCl(填化学式).
(5)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为NCl3.B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:NC15+3H2O=HNO3+5HCl.
(6)A、B、C三种元素形成的一种常见化合物,其浓溶液在常温下可与铜反应,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O.
分析 A、B、C、D、E、F六种短周期元素的原子序数依次增大,A能分别与B、C形成电子总数都为10的分子,且A与C能形成两种常温下为液态的化合物,两种液态化合物为H2O、H2O2,可知A为H元素、C为O元素,A、B的最外层电子数之和与C的最外层电子数相等,则B为N元素,A与D同主族、C与E同主族,D、E、F同周期,则D为Na、E为S、F为Cl,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素的原子序数依次增大,A能分别与B、C形成电子总数都为10的分子,且A与C能形成两种常温下为液态的化合物,两种液态化合物为H2O、H2O2,可知A为H元素、C为O元素,A、B的最外层电子数之和与C的最外层电子数相等,则B为N元素,A与D同主族、C与E同主族,D、E、F同周期,则D为Na、E为S、F为Cl.
(1)C为元素,在周期表中的位置为:第二周期VIA族,故答案为:第二周期VIA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:S2->Cl->Na+,故答案为:S2-;
(3)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物为NaOH,电子式为 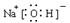 ,故答案为:
,故答案为: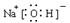 ;
;
(4)非金属性Cl>S,则气态氢化物的稳定为HCl>H2S,故答案为:HCl;
(5)N与Cl两种元素形成的一种化合物中各原子均满足8电子的稳定结构,该化合物为NCl3,两种元素还能形成另一种化合物,其中N元素显最高正价,该化合物为NCl5,该化合物能与水反应生成两种酸,该化合物与水反应的化学方程式:NC15+3H2O=HNO3+5HCl,
故答案为:NCl3;NC15+3H2O=HNO3+5HCl.
(6)A为H元素,B为N元素,C为O元素,三种元素形成的一种常见化合物,其浓溶液在常温下可与铜反应,该化合物为HNO3,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O.
点评 本题考查位置结构性质的关系及应用,综合性较强,考查知识点较多,推断元素是解答本题的关键,A与C形成的化合物常温下为液态是推断突破口,熟悉元素化合物的性质.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 纤维素和淀粉的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| B. | 油脂的酸性条件下的水解叫皂化反应 | |
| C. | 将AlCl3溶液和Al2(SO4)3溶液分别蒸干灼烧,所得产物的成分均为Al2O3 | |
| D. | 由反应AgCl (s)+KI(aq)?AgI(s)+KCl(aq)可知Ksp(AgCl)>Ksp(AgI) |
| A. | NaOH | B. | H2 | C. | NaCl | D. | H2S |
(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
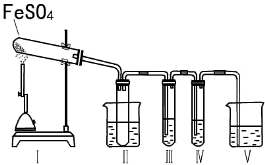
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸(或“用作安全瓶”).
②装置Ⅲ中的试剂可以是C (选填序号,下同),现象是产生白色沉淀,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是B、E.
A.2mol/LNa2CO3溶液 B.品红溶液 C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2 E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
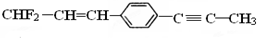
| A. | 所有原子共面 | |
| B. | 12个碳原子不可能共平面 | |
| C. | 除苯环外的其余碳原子不可能共直线 | |
| D. | 除苯环外的其余碳原子可能共直线 |
| A. | 葡萄糖可以水解成乙醇 | B. | 石油裂解气产物可用于制备塑料 | ||
| C. | CH2═CH2和CH3CH2Cl 都属于烃 | D. | 蛋白质、油脂均属高分子化合物 |
 具有相同官能团的同分异构体的结构简式为CH2=CH-CH2COOH,CH3-CH=CH-COOH.
具有相同官能团的同分异构体的结构简式为CH2=CH-CH2COOH,CH3-CH=CH-COOH.