题目内容
8.下列金属单质,活泼性最强的是( )| A. | Na | B. | Mg | C. | Al | D. | Fe |
分析 同周期从左向右金属性减弱,结合金属活动性顺序表来解答.
解答 解:Na、Mg、Al位于同周期,结合金属活动性顺序可知,金属性为Na>Mg>Al>Fe,则金属性最强的为Na,
故选A.
点评 本题考查金属元素的性质,为高频考点,把握元素在周期表的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案 精英口算卡系列答案
精英口算卡系列答案
相关题目
18.下列说法正确的是( )
| A. | 植物油的主要成分是高级脂肪酸 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |
19.回归、改进、拓展教材实验,是高考化学实验考查的常见形式.
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究.基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理.
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性.
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式2H2O2$\frac{\underline{\;三价铁离子\;}}{\;}$2H2O+O2↑.
(2)①该催化剂中铁元素的化合价为+3.
②如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:微波水热法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是Co2+.
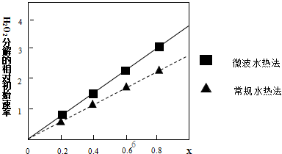
II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
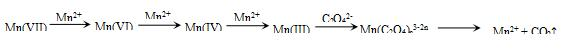
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
【设计、完成实验】
(3)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL 0.10mol/L H2C2O4溶液.在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶
(4)完成探究,记录数据
仔细阅读分析表中数据,回答问题:
x=25mL,假设2成立(填“1”、“2”或“3”)
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究.基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理.
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性.
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式2H2O2$\frac{\underline{\;三价铁离子\;}}{\;}$2H2O+O2↑.
(2)①该催化剂中铁元素的化合价为+3.
②如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:微波水热法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是Co2+.

II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
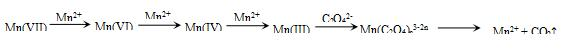
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
【设计、完成实验】
(3)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL 0.10mol/L H2C2O4溶液.在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶
(4)完成探究,记录数据
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | \ | 18 |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
x=25mL,假设2成立(填“1”、“2”或“3”)
3.合成人造羊毛: 的单体正确的是( )
的单体正确的是( )
 的单体正确的是( )
的单体正确的是( )| A. |  | B. | CH3-CN | C. | CH2═CHCN | D. | CH2═HCN |
13.用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 1molN2所含有的原子数为NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | 标准状况下,22.4LO2所含的分子数为NA | |
| D. | 1L0.2mol/LKCl溶液中所含的K+为2NA |
18.对C、N、O元素的有关比较表述不正确的是( )
| A. | 氢化物稳定性:CH4<NH3<H2O | B. | 第一电离能:C<N<O | ||
| C. | 电负性:C<N<O | D. | 氢化物沸点:CH4<NH3<H2O |