题目内容
8.在密闭容器中充入1molH2和1molI2,压强为P(Pa),并在 一定温度下反应:H2(g)+I2(g)=2HI(g)△H<0.写出下列条件下反应速率v(反)的变化(填“增大”,“减小”或“不变”)(1)容积不变,加入1molH2,v(反)增大..
(2)容积不变,加入1molHe,v(反)不变.
(3)升高温度,v(反)增大.
(4)压强不变,加入1molHe,v(反)减小.
(5)压强不变,加入1molH2(g)和1molI2(g),v(反)不变.
分析 在恒定温度下,反应速率的影响因素取决于浓度和压强,浓度越大,反应速率越大,如通入和反应物无关气体,参加反应的物质的浓度不变,则反应速率不变,如压强不变,通入和反应无关的气体,但体积增大,反应物的浓度减小,则反应速率减小,以此解答该题.
解答 解:(1)容积不变,加入1molH2,正逆反应速率都增大,故答案为:增大;
(2)容积不变,加入1molHe,浓度不变,则反应速率不变,故答案为:不变;
(3)升高温度,正逆反应速率都增大,故答案为:增大;
(4)压强不变,加入1molHe,应增大体积,浓度减小,反应速率减小,故答案为:减小;
(5)压强不变,加入1molH2(g)和1molI2(g),浓度不变,反应速率不变,故答案为:不变.
点评 本题考查化学反应速率,侧重于影响因素的考查,难度不大,注意把握影响因素,注意非反应气体对反应速率的影响.

练习册系列答案
相关题目
3.下列过程属于人工固氮的是( )
| A. | 分离液态空气制氮气 | B. | 闪电时氮气转化为NO | ||
| C. | 工业合成氨 | D. | 豆科植物根瘤菌将氮气转化为氨气 |
19.某化学兴趣小组的成员捡到一块矿石,观察外观发现该矿石坚硬且呈红褐色,投入水中没有任何变化,再向水中加浓盐酸至过量,矿石部分溶解,并有大量无色气体产生.该兴趣小组的同学们猜测该矿石可能由CaCO3、SiO2、Fe2O3三种成分组成,试设计实验证明该矿石含除CaCO3以外的两种成分.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗;2mol•L-1盐酸、2mol•L-1 NaOH溶液、2% KSCN溶液.
(1)将实验方案用如图所示流程图表示,试写出每步所用试剂的名称或化学式.
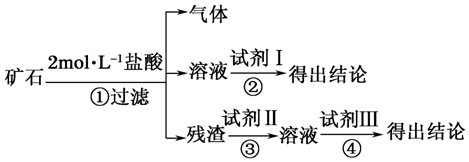
试剂Ⅰ2%的KSCN溶液;试剂Ⅱ2mol•L-1NaOH溶液;试剂Ⅲ2mol•L-1盐酸.
(2)如果猜测是成立的,试根据上述实验方案,完成实验操作、预期现象与结论.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗;2mol•L-1盐酸、2mol•L-1 NaOH溶液、2% KSCN溶液.
(1)将实验方案用如图所示流程图表示,试写出每步所用试剂的名称或化学式.

试剂Ⅰ2%的KSCN溶液;试剂Ⅱ2mol•L-1NaOH溶液;试剂Ⅲ2mol•L-1盐酸.
(2)如果猜测是成立的,试根据上述实验方案,完成实验操作、预期现象与结论.
| 编号 | 实验操作 | 预期现象与结论 |
| ① | 取适量矿石研细,加足量2mol•L-1盐酸 | 有大量无色气体产生,得棕黄色溶液,且仍有少量固体残留 |
| ② | ||
| ③ | 取①操作残余固体适量置于烧杯,加入足量2mol•L-1NaOH溶液,充分搅拌 | 残余固体完全溶解于2mol•L-1NaOH溶液,并得无色溶液 |
| ④ |
3.化学与社会、生活密切相关.对下列现象或事实的解释错误的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用浸有酸性高锰酸钾溶液的硅藻土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| B | 加热能杀死流感病毒 | 病毒的蛋白质受热变性 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | Al(OH)3用作塑料的阻燃剂 | A(OH)3受热易分解,产生水吸收热量 |
| A. | A | B. | B | C. | C | D. | D |
13.设NA表示阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 14g由N2和13C2H2组成的混合物所含的电子数为7NA | |
| B. | 1mol氨基(-NH2)中含有电子数目为10NA | |
| C. | 一定条件下,1molN2和3molH2充分反应,转移电子数目为2NA | |
| D. | 常温下,1LPH=3的Al2(SO4)3溶液中,水电离出的H+数目为10-3NA |
20.下列对化学反应速率的叙述中错误的是( )
| A. | 化学反应速率是表示反应激烈程度的一个数据 | |
| B. | 反应速率是用单位时间内某反应物或生成物的浓度变化表示的 | |
| C. | 反应中不同物质单位时间内浓度变化来表示的同一个反应的速率,其数值可能不同 | |
| D. | 影响化学反应速率最大的因素是温度 |
17.下列离子方程式中,书写正确的是( )
| A. | 亚硫酸钠溶液中加入足量稀硝酸:SO32-+2H-→SO2↑+H2O | |
| B. | 氢氧化钡和硫酸铵两种溶液混合加热:OH-+NH4+$\stackrel{△}{→}$H2O+NH3↑ | |
| C. | 氧化铜溶于稀硫酸中:O2-+2H+→H2O | |
| D. | 硫化氢气体通入氢氧化钠溶液中:H2S+2OH-→2H2O+S2- |
18.亚硝酸(HNO2)参加反应时,既可作氧化剂,又可作还原剂.当它只作氧化剂时,可能生成的产物是( )
| A. | NO2 | B. | N2 | C. | HNO3 | D. | NO |
