��Ŀ����
����ѧ��ѡ��3�����ʽṹ�����ʡ�������ʹ�ý�������ʷ�����У�������ͭ��������֮��,�����ֽ����㷺Ӧ�õĽ�������ѧ��Ԥ�����ѣ�Ti����������Ϊ��δ�����͵Ľ�����.�Իش��������⣺

��1��TiԪ��ԭ������Ϊ22������Ԫ�����ڱ��е�λ���ǵ� ���ڵ� �壻���̬ԭ�ӵĵ����Ų�ʽΪ ��
��2����Ti�Ļ������У����Գ���+2��+3��+4���ֻ��ϼۣ�������+4�۵�Ti��Ϊ�ȶ���ƫ���ᱵ�����ȶ��Ժã���糣���ߣ���С�ͱ�ѹ������Ͳ���������ж���Ӧ�ã�ƫ���ᱵ�����о����Ľṹʾ��ͼ��ͼ1��ʾ�����Ļ�ѧʽ�� ������Ti4+������λ��Ϊ ��Ba2+������λ��Ϊ ��
��3�������µ�TiCl4���д̼��Գ�ζ����ɫ��Һ�壬�۵㩁23.2�棬�е�136.2�棬����TiCl4Ӧ��
������������ ���塣TiCl4�ڳ�ʪ�������ӷ���ˮ���ð���̣�������Ϊˮ����� ���ɡ�
��4����֪Ti3+���γ���λ��Ϊ6��������ռ乹��Ϊ�������壬��ͼ2��ʾ������ͨ��������ͼ3��ʾ�ķ�������ʾ��ռ乹�ͣ�����A��ʾ���壬M��ʾ����ԭ�ӣ�����λ������[Co(NH3)4Cl2]�Ŀռ乹��ҲΪ�������ͣ����� ��ͬ���칹�壬�뽫��ṹ����_________________��
| A�� | 10mL0.1mol/L��AlCl3��Һ | B�� | 20mL0.2mol/L��CaCl2��Һ | ||
| C�� | 30mL0.2mol/L��KCl��Һ | D�� | 10mL0.25mol/L��NaCl��Һ |
�����£�������������Һ��
�� | �� | �� | �� |
0.1 mol/L NaOH��Һ | pH = 11 NaOH��Һ | 0.1 mol/L CH3COOH��Һ | pH = 3 CH3COOH��Һ |
����˵����ȷ���ǣ� ��
A����ˮ�����H+��Ũ��c(H+)���٣���
B�����ܼ�����ˮϡ����ԭ����100��ʱ��������Һ��pH=5
C������ۻ�ϣ�����ҺpH=7���������V(NaOH)��V(CH3COOH)
D��������ܵ������ϣ�����ҺpH<7��������Ũ�ȵĹ�ϵΪ��
c(CH3COO��)+c(OH��)=c(Na+)+c(H+)
| A�� | ���������ԭ��ѧ˵���Ž��з���Ԫ�������� | |
| B�� | ��ѧ�о�����ҪĿ�ľ�����ʶ���� | |
| C�� | �о����ʵ����ʣ��������ù۲졢ʵ�顢���ࡢ�Ƚϵȷ��� | |
| D�� | ��ѧ�ҿ������۲����ϲ��ݷ��Ӻ�ԭ�ӣ���װ���Ӳ��ϡ����������ͷ��ӻ��� |


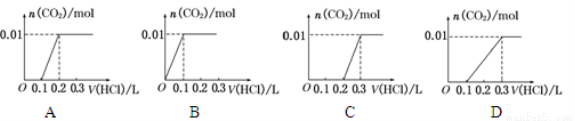
 CH3COO����H�����ڸ�ƽ�⣬����������ȷ���ǣ� ��
CH3COO����H�����ڸ�ƽ�⣬����������ȷ���ǣ� ��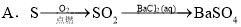
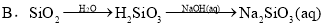
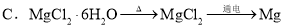

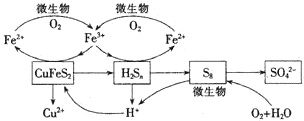 �ҹ���ͭ��Ҫȡ�Ի�ͭ��CuFeS2�������ſ�ʯƷζ�Ľ��ͺͻ���Ҫ�����ߣ�ʪ����ͭ����������ͻ�����ù��յĺ����ǻ�ͭ��Ľ�����Ŀǰ��Ҫ��������������λ����������������ַ�����
�ҹ���ͭ��Ҫȡ�Ի�ͭ��CuFeS2�������ſ�ʯƷζ�Ľ��ͺͻ���Ҫ�����ߣ�ʪ����ͭ����������ͻ�����ù��յĺ����ǻ�ͭ��Ľ�����Ŀǰ��Ҫ��������������λ����������������ַ�����