题目内容
12.图1是在实验室中模拟“氨碱法”制取NaHCO3的部分装置.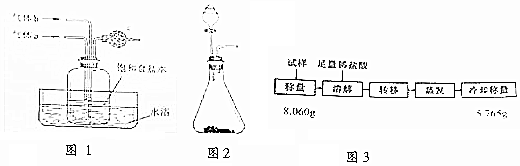
完成下列填空:
(1)仔细观察两只通气导管在瓶内所处的位置,由此推断:气体a为氨气,气体b为二氧化碳;两者的通入次序为先通a再通b.为防止尾气污染,c中可放入蘸稀硫酸溶液的脱脂棉.
(2)气体a与b均可用图2装置进行制备.当锥形瓶中固定为生石灰时,分液漏斗中应盛放浓氨水.
用该装置制备另一种气体的方法是(用离子方程式表示):CaCO3+2H+→Ca2++CO2↑+H2O.
(3)反应过程中可以看到装置饱和食盐水中有晶体逐渐析出,写出相关反应的化学方程式:NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl.
(4)反应过程中采用水浴加热,其优势是加热平稳,便于控制温度.水浴温度维持在42℃左右,温度过低,反应速率太慢,不利于晶体析出;温度过高,产物溶解度高,也不利于晶体析出.
(5)反应结束后,将热水浴换成冰水浴,冷却15min左右再进行过滤,目的是:增加碳酸氢钠的析出率,提高产率.
(6)得到的NaHCO3晶体中会含有少量NaCl杂质,可采用如图3方法进行纯度测定:该试样中NaHCO3的质量分数为0.94(精确到0.01).若称量操作无误,但最终测定结果的相对误差为1.5%,写出可能导致该结果的一种情况.产物水分未完全蒸干等.
分析 (1)根据气体的溶解性分析;氨气为碱性气体,用酸吸收;
(2)根据反应物物质状态和发生条件分析;
(3)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;
(4)水浴加热能使加热平稳,便于控制温度;温度过高,碳酸氢钠溶解度大,不利于产品的析出;
(5)反应结束后,将热水浴换成冰水浴,冷却15min左右再进行过滤,目的是减小碳酸氢钠的溶解度,提高产率;
(6)设样品中NaHCO3、NaCl的质量分别为x、y,则x+y=8.060,加盐酸,NaHCO3受热分解得到氯化钠,最终的晶体为碳酸氢钠分解产生的氯化钠和原样品中的氯化钠总质量为5.765g,据此计算;最终测定结果的相对误差为1.5%,说明比实际误差偏大,则可能为产物水分未完全蒸干.
解答 解:(1)氨气极易溶于水,二氧化碳溶于水,溶解度相对较小,为有利于二氧化碳的溶解,则通二氧化碳的导气管伸入液面之下,且先通入氨气,形成碱性溶液,吸收二氧化碳;氨气不能排放空气中,用稀硫酸吸收;
故答案为:氨气;二氧化碳;先通a再通b;稀硫酸;
(2)图2装置为固液不加热型,制备氨气时,可选用向浓氨水中加生石灰的方式制取;制备二氧化碳时,可选用向大理石中加稀盐酸的方式制取,发生的离子方程式为:CaCO3+2H+→Ca2++CO2↑+H2O,
故答案为:浓氨水;CaCO3+2H+→Ca2++CO2↑+H2O;
(3)饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,化学方程式为:NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl;
故答案为:NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl;
(4)水浴加热有利于加热平稳,便于控制温度;水浴温度维持在42℃左右,温度过低,反应速率太慢,不利于晶体析出;温度过高,产物的溶解度大,不利于晶体析出;
故答案为:加热平稳,便于控制温度;产物溶解度高;
(5)碳酸氢钠的溶解度随温度的降低而降低,反应结束后,将热水浴换成冰水浴,冷却15min左右再进行过滤,目的是增加碳酸氢钠的析出率,提高产率;
故答案为:增加碳酸氢钠的析出率,提高产率;
(6)设样品中NaHCO3、NaCl的质量分别为x、y,则x+y=8.060,加盐酸,NaHCO3受热分解得到氯化钠,根据反应NaHCO3+HCl→NaCl+CO2↑+H2O,通过反应得到的氯化钠质量为:$\frac{58.5x}{84}$,最终的晶体为碳酸氢钠分解产生的氯化钠和原样品中的氯化钠总质量为5.765g,则$\frac{58.5x}{84}+y$=5.765,联合两式解得x=7.56g,该试样中NaHCO3的质量分数为$\frac{7.56}{8.060}×100%$=0.94;最终测定结果的相对误差为1.5%,说明比实际误差偏大,则可能为产物水分未完全蒸干;
故答案为:0.94;产物水分未完全蒸干等.
点评 本题乙氨碱法为载体,考查了物质分析判断,碳酸氢钠、氨气、二氧化碳的性质,气体制备与装置选择,计算等知识点,掌握工艺流程和反应原理是解题关键,题目难度中等.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | 标准状况下,22.4 L乙醇中分子数为NA | |
| B. | 含有NA个氦原子的氦气在标准状况下的体积约为22.4L | |
| C. | 1.8g的NH4+中含有的电子数为1.1NA | |
| D. | 在1 L 2 mol/L的盐酸中,存在2NA个氯化氢分子 |
| A. |  配制溶液 | B. |  中和滴定 | ||
| C. |  除去溴苯中少量的溴单质 | D. |  制取并收集氨气 |
| A. | 只有氢离子 | B. | c(H+)=1.0×107mol/L | ||
| C. | c(H+)>c(OH-) | D. | c(H+)越大,酸性越小 |
| A. | 加入烧碱 | B. | 利用溶解度不同,常用结晶法 | ||
| C. | 直接加热法 | D. | 加入某种合适的酸溶液 |