题目内容
实验室配制480mL0.2mol?L-1的FeSO4溶液,具体操作步骤为:
①在天平上称取一定质量的绿矾(FeSO4?7H2O),把它放在烧杯中,用适量的蒸馏水使其完全溶解;
②把制得的溶液小心的注入500mL的容量瓶中;
③继续向容量瓶中滴加蒸馏水至液面距刻度线1~2cm处时,改用胶头滴管小心滴加,直到溶液的凹液面恰好与刻度线相切为止;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都转入容量瓶中,并轻轻摇匀;
⑤将容量瓶塞好,充分摇匀. 请填写下列空白.
(1)用托盘天平称取的绿矾的质量为: ;
(2)上述操作的正确顺序为: ;
(3)本次实验用到的仪器有:玻璃棒、托盘天平、药匙、烧杯、量筒、 在配制溶液的过程中多次用到玻璃棒,在溶解时玻璃棒的作用是: ,在移液时玻璃棒的作用是: .
(4)观察液面时,若俯视刻度线,会使所配制的溶液的浓度 (填“偏高”、“偏低”或“无影响”下同);加蒸馏水时不慎超过了刻度线后倒出部分溶液,使液面与刻度线相切,所配制的溶液浓度会 ;
(5)用ρ=1.84g?mL-1,质量分数为98%的浓硫酸配制200mL 1mol?L-1的稀硫酸时与上述配制溶液的步骤上的差别主要有三点:
①计算:理论上应取浓硫酸的体积V= mL(精确到小数点后两位);
②量取:由于量筒是一种粗略的量具,如想精确量取,必需选用 (填仪器名称).
③溶解:稀释浓硫酸的方法 .
①在天平上称取一定质量的绿矾(FeSO4?7H2O),把它放在烧杯中,用适量的蒸馏水使其完全溶解;
②把制得的溶液小心的注入500mL的容量瓶中;
③继续向容量瓶中滴加蒸馏水至液面距刻度线1~2cm处时,改用胶头滴管小心滴加,直到溶液的凹液面恰好与刻度线相切为止;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次的洗涤液都转入容量瓶中,并轻轻摇匀;
⑤将容量瓶塞好,充分摇匀. 请填写下列空白.
(1)用托盘天平称取的绿矾的质量为:
(2)上述操作的正确顺序为:
(3)本次实验用到的仪器有:玻璃棒、托盘天平、药匙、烧杯、量筒、
(4)观察液面时,若俯视刻度线,会使所配制的溶液的浓度
(5)用ρ=1.84g?mL-1,质量分数为98%的浓硫酸配制200mL 1mol?L-1的稀硫酸时与上述配制溶液的步骤上的差别主要有三点:
①计算:理论上应取浓硫酸的体积V=
②量取:由于量筒是一种粗略的量具,如想精确量取,必需选用
③溶解:稀释浓硫酸的方法
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)依据配置溶液的体积选择合适的容量瓶,依据n=CV,m=nM计算需要绿矾的质量;
(2)依据用固体配置一定物质的量浓度溶液的操作步骤解答;
(3)根据用固体配一定物质的量浓度溶液的操作步骤选取实验仪器;
(4)分析操作对溶液的体积的影响,根据c=
判断对浓度的影响.
(5)①依据C=
计算浓硫酸的物质的量浓度,依据稀释前后溶液所含溶质的物质的量不变计算需要浓硫酸的体积,据此选择合适的量筒;
②依据量筒与滴定管的精确度选择仪器;
③依据浓硫酸吸收的正确操作方法解答.
(2)依据用固体配置一定物质的量浓度溶液的操作步骤解答;
(3)根据用固体配一定物质的量浓度溶液的操作步骤选取实验仪器;
(4)分析操作对溶液的体积的影响,根据c=
| n |
| V |
(5)①依据C=
| 1000ρω |
| M |
②依据量筒与滴定管的精确度选择仪器;
③依据浓硫酸吸收的正确操作方法解答.
解答:
解:(1)配制480mL0.2mol?L-1的FeSO4溶液,应选择500ml的容量瓶,需要硫酸亚铁的物质的量=0.5L×0.2mol?L-1=0.1mol,需要绿矾质量为:0.1mol×278g/mol=27.8g;
故答案为:27.8g;
(2)用固体配置一定物质的量浓度溶液的一般步骤为称量、溶解、移液、洗涤、定容、摇匀等操作,
故答案为:①②④③⑤;
故答案为:①②④③⑤;
(3)配制硫酸亚铁溶液所需的仪器有:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,在溶解时用玻璃棒搅拌,可以加速固体的溶解;移液时,因为容量瓶的瓶颈细长,应用玻璃棒将溶液引流入容量瓶中;
故答案为:500mL容量瓶、胶头滴管;搅拌,加快溶解;引流;
(4)观察液面时,若俯视刻度线,导致溶液的体积偏大,溶液的浓度偏低;加蒸馏水时不慎超过了刻度线后倒出部分溶液,使液面与刻度线相切,导致溶质的物质的量偏小,溶液的浓度偏低;
故答案为:偏低;偏低;
(5)①ρ=1.84g?mL-1,质量分数为98%的浓硫酸的物质的量浓度C=
=
=18.4mol/L,设需要浓硫酸的体积为V,依据稀释前后溶液所含溶质的物质的量不变得V×18.4mol/L=200mL×1mol?L-1,
解得V=10.87ml;
故答案为:10.87;
②量筒的精确度为0.1ml,滴定管的精确度为0.01ml,浓硫酸具有氧化性,所以应选用酸性滴定管;
故答案为:酸性滴定管;
③稀释浓硫酸时浓硫酸溶于水会会放出大量的热,水的密度比浓硫酸的密度小,所以如果将水倒入浓硫酸中水会浮在浓硫酸的上面而沸腾造成液滴飞溅,所以稀释浓硫酸一定要将浓硫酸沿着容器壁慢慢倒入水中并不断搅拌使热量迅速散失;
故答案为:把浓硫酸沿着器壁慢慢地注入水中,并不断搅动,使产生的热迅速地扩散.
故答案为:27.8g;
(2)用固体配置一定物质的量浓度溶液的一般步骤为称量、溶解、移液、洗涤、定容、摇匀等操作,
故答案为:①②④③⑤;
故答案为:①②④③⑤;
(3)配制硫酸亚铁溶液所需的仪器有:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,在溶解时用玻璃棒搅拌,可以加速固体的溶解;移液时,因为容量瓶的瓶颈细长,应用玻璃棒将溶液引流入容量瓶中;
故答案为:500mL容量瓶、胶头滴管;搅拌,加快溶解;引流;
(4)观察液面时,若俯视刻度线,导致溶液的体积偏大,溶液的浓度偏低;加蒸馏水时不慎超过了刻度线后倒出部分溶液,使液面与刻度线相切,导致溶质的物质的量偏小,溶液的浓度偏低;
故答案为:偏低;偏低;
(5)①ρ=1.84g?mL-1,质量分数为98%的浓硫酸的物质的量浓度C=
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |
解得V=10.87ml;
故答案为:10.87;
②量筒的精确度为0.1ml,滴定管的精确度为0.01ml,浓硫酸具有氧化性,所以应选用酸性滴定管;
故答案为:酸性滴定管;
③稀释浓硫酸时浓硫酸溶于水会会放出大量的热,水的密度比浓硫酸的密度小,所以如果将水倒入浓硫酸中水会浮在浓硫酸的上面而沸腾造成液滴飞溅,所以稀释浓硫酸一定要将浓硫酸沿着容器壁慢慢倒入水中并不断搅拌使热量迅速散失;
故答案为:把浓硫酸沿着器壁慢慢地注入水中,并不断搅动,使产生的热迅速地扩散.
点评:本题考查了一定物质的量浓度溶液的配制以及浓硫酸的稀释,注意实验的基本操作方法和注意事项,误差分析时,注意从c=
分析操作对溶质的物质的量或对溶液的体积的影响判断,题目难度不大.
| n |
| V |

练习册系列答案
相关题目
世博会中国馆、主题馆等建筑使用光伏并网发电,总功率达4兆瓦,是历届世博会之最.通过并网,上海市使用半导体照明(LED).已知发出白光的LED是由GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的.下列有关叙述正确的是( )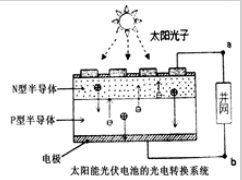

| A、光伏电池是将太阳能直接转变为电能 |
| B、图中N型半导体为正极,P型半导体为负极 |
| C、电流从a流向b |
| D、LED中的Ga和Y都显+3价 |
下列关于油脂的叙述错误的是( )
| A、从溴水中提取溴可用植物油做萃取剂 |
| B、用热的纯碱溶液可区别植物油和矿物油 |
| C、含Ca2+、Mg2+的水使肥皂去污能力减弱是因为发生了沉淀反应 |
| D、生产盐酸和人造脂肪必须用氢气做原料 |
在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A、v(NH3)=0.3mol/(L?min) |
| B、v (N2)=0.2 mol/(L?min) |
| C、v (N2)=0.01mol/(L?s) |
| D、v (H2)=0.3 mol/(L?min) |
光纤通讯是一种现代化的通讯手段,光导纤维的成分是( )
| A、Na2SiO3 |
| B、Si |
| C、SiO2 |
| D、CaCO3 |
N2O5是一种新型绿色硝化剂,其性质和制备受到人们的关注.已知一定条件下会发生反应:2N2O5(g)?4NO2(g)+O2(g)△H>0,平衡常数为K.下列叙述正确的是( )
| A、上述反应的平衡常数随温度升高而增大 |
| B、上述反应达到平衡后,只增大氧气浓度,因为K值变大了,所以平衡将向左移动 |
C、N2O5与苯发生硝化反应除了生成硝基苯(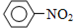 ),还有氧气生成 ),还有氧气生成 |
| D、以N2O4等为原料采用电化学方法可以合成N2O5,该合成应避免碱性环境 |