题目内容
(1)2.00g C2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,请写出表示C2H2燃烧热的热化学方程式:
(2)C2H2可用于制作燃料电池,请写以KOH溶液为电解质溶液的乙炔燃料电池的负极反应式:
(3)用乙炔燃料电池电解AgNO3溶液,用石墨做电解池两极,请写出与电源负极相连的石墨电极的电极反应式:
(4)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,请写出该电池在充电时阴极的电极反应式: .
(2)C2H2可用于制作燃料电池,请写以KOH溶液为电解质溶液的乙炔燃料电池的负极反应式:
(3)用乙炔燃料电池电解AgNO3溶液,用石墨做电解池两极,请写出与电源负极相连的石墨电极的电极反应式:
(4)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
| 放电 |
| 充电 |
考点:化学电源新型电池
专题:电化学专题
分析:(1)依据热化学方程式的书写方法进行解答,注意标注物质聚集状态和对应焓变;
(2)乙炔燃料电池中,负极上是乙炔发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,又因为电解质是KOH溶液,不会在电极上放出二氧化碳;
(3)电解AgNO3溶液时,与电源负极相连的是阴极,阴极上是银离子得电子;
(4)充电时,阴极发生还原反应,Zn(OH)2被还原生成Zn.
(2)乙炔燃料电池中,负极上是乙炔发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,又因为电解质是KOH溶液,不会在电极上放出二氧化碳;
(3)电解AgNO3溶液时,与电源负极相连的是阴极,阴极上是银离子得电子;
(4)充电时,阴极发生还原反应,Zn(OH)2被还原生成Zn.
解答:
解:(1)2.00g乙炔是
=
mol,其完全燃烧生成液态水和二氧化碳放出99.6kJ热量,1mol乙炔燃烧放热1294.8KJ,则乙炔燃烧的热化学方程式为C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1294.8kJ/mol,故答案为:C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1294.8kJ/mol;
(2)乙炔燃料电池以KOH溶液为电解质溶液时,负极上是乙炔发生失电子的氧化反应,又因为电解质是KOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即C2H2+14OH--10e-=2CO32-+8H2O,故答案为:C2H2+14OH--10e-=2CO32-+8H2O;
(3)阴极上是银离子得电子,电极反应式为:Ag++e-═Ag,故答案为:Ag++e-═Ag;
(4)充电时,阴极发生还原反应,Zn(OH)2被还原生成Zn,电极方程式为Zn(OH)2+2e-═Zn+2OH-,故答案为:Zn(OH)2+2e-═Zn+2OH-.
| 2.00g |
| 26g/mol |
| 1 |
| 13 |
| 5 |
| 2 |
| 5 |
| 2 |
(2)乙炔燃料电池以KOH溶液为电解质溶液时,负极上是乙炔发生失电子的氧化反应,又因为电解质是KOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即C2H2+14OH--10e-=2CO32-+8H2O,故答案为:C2H2+14OH--10e-=2CO32-+8H2O;
(3)阴极上是银离子得电子,电极反应式为:Ag++e-═Ag,故答案为:Ag++e-═Ag;
(4)充电时,阴极发生还原反应,Zn(OH)2被还原生成Zn,电极方程式为Zn(OH)2+2e-═Zn+2OH-,故答案为:Zn(OH)2+2e-═Zn+2OH-.
点评:本题考查了热化学方程式书写、电极反应式书写,题目难度中等.

练习册系列答案
相关题目
在铁和氧化铁混合物15g中,加入稀硫酸150mL,能发出H21.68L(标准状况).同时铁和氧化铁均无剩余,向反应后的溶液中滴入KSCN溶液,未见颜色变化.为了中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,共消耗3mol?L-1的NaOH溶液200mL,则硫酸的物质的量浓度是( )
| A、1.5mol?L-1 |
| B、2mol?L-1 |
| C、2.5mol?L-1 |
| D、3mol?L-1 |
某金属硝酸盐加热分解生成的NO2和O2的物质的量之比是3:1,则在加热过程中,该金属元素的化合价( )
| A、降低 | B、升高 |
| C、不变 | D、无法确定 |
已知在粗碘中含ICl和IBr,受热时ICl、IBr均可升华;若在粗碘中加入一种物质再进行升华,则可制得精碘.在下列物质中,应加入的物质是( )
| A、H2O |
| B、Zn |
| C、KI |
| D、NaCl |
MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600~700℃,所用燃料为H2,电解质为熔融的K2CO3.该电池的总反应式为:2H2+O2=2H2O,负极反应为:H2+CO32--2e-=H2O+CO2.则下列推断中,正确的是( )
| A、正极反应为4OH--4e-=2H2O+O2↑ |
| B、放电时CO32-向负极移动 |
| C、当生成1 mol水时,转移4 mol电子 |
| D、通H2的一极为负极,发生还原反应 |
某原电池装置如图所示,盐桥中装有用饱和氯化钾溶液浸泡过的琼脂.下列叙述正确的是( )
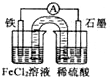

| A、原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 |
| B、此电池工作原理与硅太阳能电池工作原理相同 |
| C、Fe为正极,石墨上发生的反应为:2H++2e-═H2↑ |
| D、若装置中的盐桥用铁丝代替,电流表指针无偏转 |
物质的性质决定物质的用途.下列因果关系不成立的是( )
| A、因为红磷燃烧能产生大量白烟,所以可用于制作烟幕弹 |
| B、因为铜的化学性质不活泼,所以可镀在某些铁制品表面防止铁生锈 |
| C、因为氮气的化学性质不活泼,所以常用于食品包装袋内防变质 |
| D、因为CO有可燃性,所以常用于冶炼金属 |
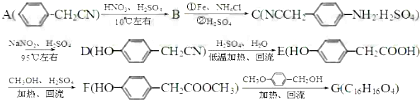
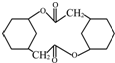 的合成路线流程图(无机试剂任选).合成路线流程图示例:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例:CH3CH2OH