题目内容
 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图坐标曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图坐标曲线来表示,回答下列问题:(1)曲线由0→a段不产生氢气的原因
(2)曲线由a→b段产生氢气的速率较慢的原因
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因
考点:铝的化学性质,化学反应速率的影响因素
专题:化学反应速率专题
分析:由图可知,开始不生成氢气,为氧化铝与硫酸的反应,然后Al与硫酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,后来,氢离子浓度减小,则反应速率减小,以此来解答.
解答:
解:(1)曲线由0→a段不产生氢气是因氧化铝与硫酸反应生成硫酸铝和水,离子反应为Al2O3+6H+=2Al3++3H2O,
故答案为:氧化铝与硫酸反应生成硫酸铝和水;Al2O3+6H+=2Al3++3H2O;
(2)曲线由a→b段产生氢气的速率较慢是因开始时温度较低,反应速率较慢,发生2Al+3H2SO4=Al2(SO4)3+3H2↑,
故答案为:开始时温度较低;2Al+3H2SO4=Al2(SO4)3+3H2↑;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,故答案为:该反应为放热反应;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,故答案为:氢离子浓度减小.
故答案为:氧化铝与硫酸反应生成硫酸铝和水;Al2O3+6H+=2Al3++3H2O;
(2)曲线由a→b段产生氢气的速率较慢是因开始时温度较低,反应速率较慢,发生2Al+3H2SO4=Al2(SO4)3+3H2↑,
故答案为:开始时温度较低;2Al+3H2SO4=Al2(SO4)3+3H2↑;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,故答案为:该反应为放热反应;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,故答案为:氢离子浓度减小.
点评:本题考查Al的化学性质及影响反应速率的因素,为高频考点,把握温度、浓度对反应速率的影响及氧化铝、Al与酸的反应为解答的关键,侧重分析能力的考查,题目难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
根据已知条件,对物质的性质强弱判断不正确的是( )
| A、已知HF的共价键键能比HCl大,说明稳定性:HF>HCl | ||||
| B、已知正反应的活化能大于逆反应的活化能,说明总能量:生成物>反应物 | ||||
| C、已知NaClO+SO2+H2O→HClO+Na2SO3,说明给出质子能力:HSO3->HClO | ||||
D、已知CaCO3+SiO2
|
乙酸和乙醇在浓硫酸存在的条件下发生反应,生成的有机物的相对分子质量是88.今有分子量比乙醇大16的有机物和乙酸在相似的条件下发生类似的反应,生成的有机物的相对分子质量为146,下列叙述正确的是( )
| A、是丙三醇和乙酸发生了酯化反应 |
| B、生成的有机物是乙酸丙酯 |
| C、分子量为146的有机物可以发生水解反应 |
| D、发生的反应属消去反应 |

 如图表示一个电解池.X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液.
如图表示一个电解池.X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液.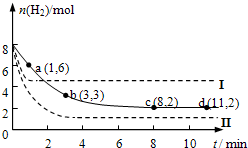 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q(Q>0)某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标).回答下列问题:
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q(Q>0)某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标).回答下列问题: 和
和 ; ②
; ② 和
和 ;
;