题目内容
图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为 .
(2)装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象: .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是 (填编号).
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 ,该现象 (填“能”或“不能”),说明溴的非金属性强于碘,原因是 .
(5)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式: .请判断改用NaHSO3溶液是否可行? (填“是”或“否”).

(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:
考点:制备实验方案的设计,氯气的实验室制法,氯、溴、碘的性质实验
专题:实验题
分析:(1)漂粉精固体和浓盐酸,发生氧化还原反应生成氯化钙、氯气和水;
(2)氯气中混有HCl,B中饱和食盐水可吸收HCl;C中若发生堵塞,则B中长颈漏斗下端导管中液面会上升;
(3)验证氯气是否具有漂白性,则先设计湿润的有色物质,再利用干燥剂干燥后与干燥的有色物质混合;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘;
(5)F中可改用足量的NaHSO3溶液吸收余氯,发生氧化还原反应,可能生成二氧化硫,污染环境.
(2)氯气中混有HCl,B中饱和食盐水可吸收HCl;C中若发生堵塞,则B中长颈漏斗下端导管中液面会上升;
(3)验证氯气是否具有漂白性,则先设计湿润的有色物质,再利用干燥剂干燥后与干燥的有色物质混合;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘;
(5)F中可改用足量的NaHSO3溶液吸收余氯,发生氧化还原反应,可能生成二氧化硫,污染环境.
解答:
解:(1)漂粉精固体和浓盐酸,发生氧化还原反应生成氯化钙、氯气和水,该反应为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
(2)氯气中混有HCl,B中饱和食盐水可吸收HCl,则装置B的作用为除去氯气中的HCl;C中若发生堵塞,生成的氯气使B中压强增大,则B中长颈漏斗下端导管中液面会上升,形成水柱,故答案为:除去氯气中的HCl;B中长颈漏斗下端导管中液面会上升,形成水柱;
(3)验证氯气是否具有漂白性,则先通过I中湿润的有色布条,观察到褪色,再利用II中固体干燥剂(无水氯化钙或硅胶)干燥后,在Ⅲ中放入干燥的有色布条,观察到颜色不褪,则验证氯气不具有漂白性,只有d符合,故答案为:d;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘,则E中碘易溶于苯,出现分层后上层为紫红色的苯层,该现象不能说明溴的非金属性强于碘,过量的氯气也可将碘离子氧化,应排除氯气的干扰,
故答案为:E中溶液分为两层,上层为紫红色;不能;过量的氯气也可将碘离子氧化;
(5)F中可改用足量的NaHSO3溶液吸收余氯,发生氧化还原反应,离子反应为HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O),可能生成二氧化硫,污染环境,则不能用NaHSO3溶液吸收尾气,
故答案为:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O);否.
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
(2)氯气中混有HCl,B中饱和食盐水可吸收HCl,则装置B的作用为除去氯气中的HCl;C中若发生堵塞,生成的氯气使B中压强增大,则B中长颈漏斗下端导管中液面会上升,形成水柱,故答案为:除去氯气中的HCl;B中长颈漏斗下端导管中液面会上升,形成水柱;
(3)验证氯气是否具有漂白性,则先通过I中湿润的有色布条,观察到褪色,再利用II中固体干燥剂(无水氯化钙或硅胶)干燥后,在Ⅲ中放入干燥的有色布条,观察到颜色不褪,则验证氯气不具有漂白性,只有d符合,故答案为:d;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘,则E中碘易溶于苯,出现分层后上层为紫红色的苯层,该现象不能说明溴的非金属性强于碘,过量的氯气也可将碘离子氧化,应排除氯气的干扰,
故答案为:E中溶液分为两层,上层为紫红色;不能;过量的氯气也可将碘离子氧化;
(5)F中可改用足量的NaHSO3溶液吸收余氯,发生氧化还原反应,离子反应为HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O),可能生成二氧化硫,污染环境,则不能用NaHSO3溶液吸收尾气,
故答案为:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O);否.
点评:本题考查性质实验方案的制备,为高频考点,把握氯气的性质、制法、装置的作用及氧化还原反应原理为解答的关键,侧重分析能力、实验能力及知识综合应用能力的综合考查,(5)为解答的难点,题目难度中等.

练习册系列答案
相关题目
能够发生银镜反应且与丙酸互为同分异构体的是( )
| A、甲酸乙酯 | B、丙醛 |
| C、乙酸甲酯 | D、1-羟基丙酮 |
下列气体中不含甲烷的是( )
| A、天然气 | B、水煤气 |
| C、裂解气 | D、沼气 |
 如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
如图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
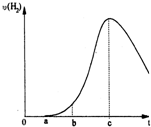 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图坐标曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图坐标曲线来表示,回答下列问题: