题目内容
15.Na2S又称臭碱、硫化碱,是应用广泛的化工原料,也常用于吸收工业废气中的SO2.完成下列填空:(1)用离子方程式说明Na2S又称臭碱、硫化碱的原因S2-+H2O?OH-+HS-、HS-+H2O?OH-+H2S.
(2)向AgCl悬浊液中滴加Na2S溶液,生成黑色沉淀,写出反应的离子方程式AgCl+S2-=Ag2S+2Cl-.结合你所学习过的其它离子反应分析,离子互换反应进行的方向是某些离子浓度减小的方向.
向Na2S溶液中不断通入SO2,直至不再能吸收,其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-,
(3)反应过程中,溶液的pH逐渐变小(填“变大”、“变小”),生成的沉淀是S;
(4)关于反应后得到的溶液,下列离子浓度关系正确的是b.
a.c(Na+)=c(S2O32-)+2c(HSO3-)+2c(H2SO3)+2c(HS-)
b.c(Na+)+c(H+)=2c(S2O32-)+c(HSO3-)+c(HS-)+c(OH-)
c.c(Na+)=2c(HS-)
分析 (1)硫化钠是强碱弱酸盐,硫离子水解生成硫氢根离子和氢氧根离子,硫氢根离子水解生成具有臭味的硫化氢;
(2)Ag2S溶解度小于AgCl溶解度,溶解度大的物质能转化为溶解度小的物质;
(3)向Na2S溶液中不断通入SO2,直至不再能吸收,其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-,硫化钠是强碱弱酸盐,硫离子水解程度远远大于硫氢根离子、亚硫酸氢根离子、硫代硫酸根离子;生成的沉淀是S;
(4)任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:(1)硫化钠是强碱弱酸盐,硫离子水解生成硫氢根离子和氢氧根离子,硫氢根离子水解生成具有臭味的硫化氢,水解方程式为S2-+H2O?OH-+HS-,HS-+H2O?OH-+H2S;
故答案为:S2-+H2O?OH-+HS-、HS-+H2O?OH-+H2S;
(2)Ag2S溶解度小于AgCl溶解度,溶解度大的物质能转化为溶解度小的物质,离子方程式为AgCl+S2-=Ag2S+2 Cl-,离子互换反应进行的方向是某些离子浓度减小的方向,
故答案为:AgCl+S2-=Ag2S+2 Cl-;某些离子浓度减小的方向;
(3)向Na2S溶液中不断通入SO2,直至不再能吸收,其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-,硫化钠是强碱弱酸盐,硫离子水解程度远远大于硫氢根离子、亚硫酸氢根离子、硫代硫酸根离子,所以溶液的pH变小;生成的沉淀是S,
故答案为:变小;S;
(4)a.根据物料守恒得c(Na+)=2c(S2O32-)+c(HSO3-)+c(H2SO3)+c(HS-),故a错误;
b.根据电荷守恒得c(Na+)+c(H+)=2c(S2O32-)+c(HSO3-)+c(HS-)+c(OH-),故b正确;
c.根据物料守恒得c(Na+)=2c(S2O32-)+c(HSO3-)+c(H2SO3)+c(HS-),所以c(Na+)>c(HS-),故c错误;
故选b.
点评 本题考查离子浓度大小比较、盐类水解等知识点,为高频考点,明确盐的性质、离子反应条件是解本题关键,多元弱酸根离子分步电离,且第一步水解程度远远大于第二步电离程度,题目难度不大.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 | |
| B. | 金属钠着火时不能使用泡沫灭火器灭火 | |
| C. | 因为NH4Cl受热易分解,实验室应保存在棕色试剂瓶中 | |
| D. | 铁粉作食品袋内的脱氧剂,起还原作用 |
| A. | 原子一定重新组合 | B. | 一定有电子转移 | ||
| C. | 有旧键断裂和新键形成 | D. | 必然伴随着能量的变化 |
| A. | CO2(CO):点燃 | |
| B. | 硝酸钾(氯化钠):浓溶液降温结晶 | |
| C. | MgSO4(MgCl2):蒸干、灼烧 | |
| D. | 乙酸(乙醛):加新制氢氧化铜浊液加热,过滤 |
| A. | Fe3+、Br-、Al3+、H+、CO32-、H2PO4-这些离子都能破坏水的电离平衡 | |
| B. | 常温下,往饱和石灰水中加入一定量的生石灰,一段时间后恢复到原温度,溶液的pH变小 | |
| C. | CuSO4、K2CO3、KMnO4的水溶液分别在空气中小心加热蒸干至质量不再减少为止,都能得到较纯净的原溶质 | |
| D. | Na2C2O4溶液中存在:c(OH-)=c(H+)+c(H2C2O4) |
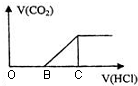 向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )
向NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同.若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图.则下列分析正确的是(不计CO2溶解)( )| A. | 若OB=0,则溶液M为Na2CO3溶液 | |
| B. | 若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2→HCO3- | |
| C. | 若溶液M中c(NaHCO3)=2c(Na2CO3),则3OB=BC | |
| D. | 若溶液M中大量存在的阴离子为CO32-和HCO3-,则OB>BC |
| A. | SiO2、CO2 都是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物相同 | |
| C. | SO2、NO、CO2都是大气污染物,在空气中都能稳定存在 | |
| D. | HCl、HNO3都是强酸,和FeO的反应都属于复分解反应 |
 ;
;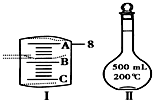 实验室要用NaCl晶体配制500mL 0.2mol•L-1NaCl溶液,回答下列问题:
实验室要用NaCl晶体配制500mL 0.2mol•L-1NaCl溶液,回答下列问题: