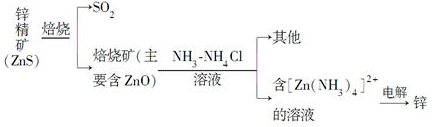
题目内容
17.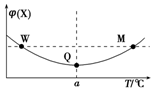 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | 升高温度,平衡常数减小 | |
| B. | W、M两点Y的正反应速率相等 | |
| C. | 平衡后充入Z达到新平衡时Z的体积分数增大 | |
| D. | M点时,Y的转化率最大 |
分析 由图可知,开始反应物的含量减少,Q点达到平衡状态,之后升高温度时X的体积分数增大,可知升高温度平衡逆向移动,则正反应为放热反应,以此来解答.
解答 解:A.Q点后升高温度平衡逆向移动,正反应为放热反应,则升高温度,平衡常数减小,故A正确;
B.温度越高,反应速率越快,则M点Y的反应速率大,故B错误;
C.恒该反应为气体体积不变的反应,容时平衡后充入Z,达到新平衡时,与原平衡为等效平衡,Z的体积分数不变,故C错误;
D.Q点为平衡点,则Q点时Y的转化率最大,故D错误;
故选A.
点评 本题考查化学平衡移动,为高频考点,把握图象分析、平衡移动、平衡状态的判断为解答的关键,侧重分析与应用能力的考查,注意该反应为放热反应,选项C为解答的难点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.在四个不同的容器中,在不同的条件下进行N2+3H2?2NH3反应.根据在相同时间内测定的结果判断,生成氨的速率最慢的是( )
| A. | υ(H2)=0.1 mol•L-1•min-1 | B. | υ(N2)=0.2 mol•L-1•min-1 | ||
| C. | υ(NH3)=0.15 mol•L-1•min-1 | D. | υ(H2)=0.3 mol•L-1•min-1 |
5.下列叙述正确的是( )
| A. | 铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下铝和浓硫酸、浓硝酸不反应 | |
| B. | 两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多 | |
| C. | 合金的熔点一般比组成它的各成分的熔点都高 | |
| D. | 工业上常利用铝热反应冶炼难熔金属,如钒、铬、锰 |
2.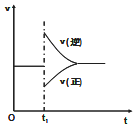 在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
2A(g)+B(g)?2C(g)△H<0.达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图.下列对t1时刻改变条件的推测中正确的是( )
 在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图.下列对t1时刻改变条件的推测中正确的是( )
| A. | 保持压强不变,升高反应温度 | |
| B. | 保持温度不变,增大容器体积 | |
| C. | 保持温度和容器体积不变,充入1 mol C(g) | |
| D. | 保持温度和压强不变,充入1 mol C(g) |
7.已知:I2+2S2O32-═S4O62-+2I-.
相关物质的溶度积常数见表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O,加入CuO,调至pH=4,使溶液
中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O.
(2)在空气中直接加热CuCl2•2H2O得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(发生反应:2Cu2++4I-═2CuI↓+I2).用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是溶液蓝色褪去,且半分钟内不变色.
②该试样中CuCl2•2H2O的质量分数为95%.
相关物质的溶度积常数见表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O.
(2)在空气中直接加热CuCl2•2H2O得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀(发生反应:2Cu2++4I-═2CuI↓+I2).用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是溶液蓝色褪去,且半分钟内不变色.
②该试样中CuCl2•2H2O的质量分数为95%.
4.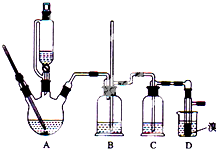 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c(填字母),其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是凝固点较低,过度冷却会使其凝固而使气路堵塞.
 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c(填字母),其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚.可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是凝固点较低,过度冷却会使其凝固而使气路堵塞.
5.下列说法中正确的是( )
| A. | 由同种分子构成的物质一定是纯净物 | |
| B. | 纯净物一定由分子构成 | |
| C. | 混合物肯定是由两种以上的元素组成的 | |
| D. | 含有氧元素的化合物就是氧化物 |