题目内容
3.在固定体积的容器中进行以下可逆反应:N2 (g)+3H2 (g)?2NH3 (g),能表明反应达平衡状态的是( )| A. | 容器内气体压强不再改变 | |
| B. | 有2mol NH3生成的同时有3mol H2反应 | |
| C. | 生成NH3的量与反应掉N2的量之比为2:1 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
分析 可逆反应N2 (g)+3H2 (g)?2NH3 (g)为气体体积缩小的反应,该反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行解答.
解答 解:A.该反应为气体体积缩小的反应,若容器内气体压强不再改变,说明各组分的浓度不再变化,证明达到平衡状态,故A正确;
B.有2mol NH3生成的同时有3mol H2反应,表示的都是正反应,无法判断平衡状态,故B错误;
C.生成NH3的量与反应掉N2的量之比为2:1,表示的都是正反应,无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故C错误;
D.N2、H2、NH3的物质的量之比为1:3:2,无法判断各组分的物质的量是否继续变化,则无法判断平衡状态,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
13.某高聚物的片断结构为 合成该高分子化合物的单体是( )
合成该高分子化合物的单体是( )
 合成该高分子化合物的单体是( )
合成该高分子化合物的单体是( )| A. | CH2=CH2 | B. | CH2=CH-CH3 | C. | CH3CH2CH3 | D. | CH3CH(CH3)CH3 |
11.东汉成书的《神农本草经》有“石胆能化铁为铜”的记载(石胆是硫酸铜).这一方法开创了人类文明史上湿法冶金的先河.其中涉及到的化学反应类型是( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
8.关于分液漏斗的使用,下列说法正确的是( )
| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 | |
| C. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 | |
| D. | 放出下层液体后,再从漏斗下端口放出上层液体. |
12.根据反应(1)~(3),可以判断下列3个物质的氧化性由强到弱的正确顺序是( )
(1)2FeCl3+H2S═2FeCl2+2HCl+S (2)H2S+I2═S+2HI (3)2FeCl3+2HI═2FeCl2+2HCl+I2.
(1)2FeCl3+H2S═2FeCl2+2HCl+S (2)H2S+I2═S+2HI (3)2FeCl3+2HI═2FeCl2+2HCl+I2.
| A. | S>I2>Fe3+ | B. | Fe3+>I2>S | C. | Fe3+>S>I2 | D. | I2>Fe3+>S |


 +
+ $→_{△}^{稀OH-}$
$→_{△}^{稀OH-}$ +H2O
+H2O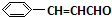 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2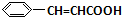 +H2O;③C与F的反应:
+H2O;③C与F的反应: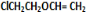 +
+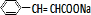 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$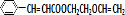 +NaCl.
+NaCl.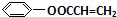 .
. ,⑤的电子式是
,⑤的电子式是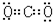 .
.