题目内容
17.下列反应在210℃时达到平衡:①PCl5(g)?PCl3(g)+Cl2(g);△H1>0 K1=1mol•L-1
②CO(g)+Cl2(g)?COCl2(g);△H1<0 K2=5×104L•mol-1
③COCl2(g)?CO(g)+Cl2(g)
④2SO2(g)+O2(g)?2SO3(g);△H4<0
(1)反应③的平衡常数K3为2×10-5 mol•L-1.
(2)要使反应①和反应②的K数值相等,可采取的措施是C(填序号).
A.降低反应①、②体系中Cl2浓度
B.反应①、②选择不同的催化剂
C.反应①、反应②同时升高温度
D.反应①、反应②同时降低温度
E.反应①降低温度,反应②维持210℃
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定.起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡.下列有关它们达到平衡状态后的叙述正确的是B(填序号).
A.体积:甲可能小于乙
B.SO3的物质的量:甲一定小于乙
C.压强:甲可能大于乙
D.浓度比$\frac{c(S{O}_{2})}{c(S{O}_{3})}$:甲一定小于乙
(4)丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为12mol.现向容器中加主xmolSO2,6.5mol O2,2.0molSO3.①若x=5.5,需要降低(填“降低”“升高”或“保持”)体系温度,使反应在平衡时达到题设要求;
②欲使起始反应维持向逆反应方向移动,则x的取值范围为2.5<x<3.5.
分析 (1)反应②、③互为正逆反应,相同温度下二者平衡常数互为倒数;
(2)平衡常数只受温度影响,要使反应①和反应②的K数值相等,则应使K1增大、K2减小,反应①正反应是吸热反应,升高温度平衡向正反应方向移动;反应②正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小;
(3)随反应进行混合气体物质的量减小,温度相同且恒定下,甲恒容,容器的体积不变,反应后压强减小;乙恒压,反应后体积缩小.乙等效为在甲平衡基础上增大压强,平衡正向移动;
(4)①若x=5.5,则5.5+6.5+2.0=14>12,需要向气体物质的量减小的方向进行;
②正反应为气体物质的量减小的反应,欲使起始反应维持向逆反应方向移动,则混合气体总物质的量之和应小于12mol,当三氧化硫完全转化时二氧化硫物质的量达极小值.
解答 解:(1)反应②、③互为正逆反应,相同温度下二者平衡常数互为倒数,③COCl2(g)?CO(g)+Cl2(g)的平衡常数K3=$\frac{1}{{K}_{2}}$=$\frac{1}{5×1{0}^{4}}$=2×10-5 mol•L-1,
故答案为:2×10-5 mol•L-1;
(2)要使反应①和反应②的K数值相等,则应使K1增大、K2减小,反应①正反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大;反应②正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,故应适当升高温度,
故选:C;
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定.起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡;
A.反应是气体体积减小的反应,甲恒容、乙恒压体积减小,所以体积甲不可能小于乙,故A错误;
B.反应是气体体积减小的反应,甲恒容、乙恒压体积减小压强增大,比甲平衡后进行程度大,平衡时乙中SO3的物质的量大:甲一定小于乙,故B正确;
C.反应是气体体积减小的反应,甲恒容压强减小、乙恒压压强不变,压强甲不可能大于乙,故C错误;
D.反应是气体体积减小的反应,甲恒容、乙恒压体积减小压强增大,比甲平衡后进行程度大,平衡时乙中SO3的物质的量大,浓度比$\frac{c(S{O}_{2})}{c(S{O}_{3})}$:甲一定大于乙,故D错误;
故答案为:B;
(4)①丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为12mol,现向容器中加xmolSO2,6.5mol O2,2.0molSO3.
①若x=5.5,则5.5+6.5+2.0=14>12,需要向气体物质的量减小的方向进行,即向正反应方向进行,反应是放热反应,需要降低温度,
故答案为:降低;
②保持容器内气体总物质的量为12mol时,正反应为气体物质的量减小的反应,欲使起始反应维持向逆反应方向移动,则混合气体总物质的量之和应小于12mol,则x+6.5+2.0<12,故x<3.5,当三氧化硫完全转化时二氧化硫物质的量达极小值,则2+x+6.5+1=12,故x=2.5,则x的取值范围为2.5<x<3.5,
故答案为:2.5<x<3.5.
点评 本题考查化学平衡常数、化学平衡计算及影响因素,(3)中掌握平衡移动原理是解题关键,(4)注意利用极限法分析解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案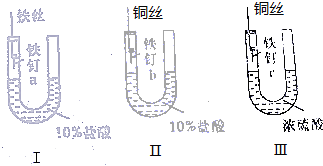 为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )| A. | 实验结束时,装置Ⅰ左侧的液面一定会下降 | |
| B. | 实验结束时,装置Ⅰ左侧的液面一定比装置Ⅱ的低 | |
| C. | 实验结束时,铁钉b腐蚀最严重 | |
| D. | 实验结束时,铁钉c几乎没有被腐蚀 |
| A. | 25% | B. | 20% | C. | 35% | D. | 30% |
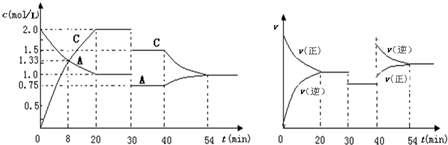
| A. | 0~20min用A物质表示反应的平均速率为0.005mol•L-1•min-1 | |
| B. | 该反应的正反应为吸热反应 | |
| C. | x=1,且30min时改变的反应条件是减压 | |
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)能判断该反应是否已达化学平衡状态的依据是bc.
a.容器中压强不变b.混合气体中c(CO)不变c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”)
(4)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为1.8mol.
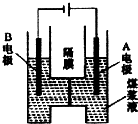 用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )
用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )| A. | A极是阳极,B极为阴极 | |
| B. | A极的电极反应式为C+2H2O-4e-=CO2↑+4H+ | |
| C. | B极的电极反应式为2H++2e-=H2↑ | |
| D. | 电解一段时间后,煤浆液的pH增大 |
| A. | Na在空气中久置最终变为过氧化钠 | |
| B. | 金属钠着火后应立即用泡沫灭火器灭火 | |
| C. | Na2O和Na2O2都是碱性氧化物 | |
| D. | Na2CO3叫纯碱,但属于盐类 |
| A. | 氧化还原反应的实质是化合价的升降 | |
| B. | 同温同压下,任何气体的分子间距离几乎相等 | |
| C. | 布朗运动是胶体区别于其他分散系的本质特征 | |
| D. | SO2的水溶液能够导电,所以SO2是电解质 |