题目内容
5.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出),其中B既能和酸反应又能和碱反应.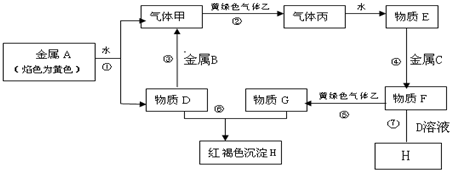
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:ANa、HFe(OH)3、FFeCl2.
(2)说出黄绿色气体乙的一种用途工业上制氯化氢,气体甲在气体乙中燃烧的现象火焰呈苍白色,在集气瓶口有雾状物质出现.
(3)区别E、F两种溶液最简单的方法是观察溶液的颜色,溶液为无色的为盐酸,呈淡绿色的为氯化亚铁,实验室检验G中所含的金属离子时,常在G的溶液中加入KSCN溶液.
(4)反应①的离子方程式为2Na+2H2O=2Na++2OH-+H2↑.
(5)反应③的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
分析 金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,E与金属C反应生成F,F与氯气反应生成G,可推知C为Fe,F为FeCl2,G为FeCl3,结合物质的性质解答该题.
解答 解:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,E与金属C反应生成F,F与氯气反应生成G,可推知C为Fe,F为FeCl2,G为FeCl3,
(1)由以上分析可知,A为Na,H是Fe(OH)3,F为FeCl2,故答案为:Na;Fe(OH)3;FeCl2;
(2)乙为Cl2,氯气在工业上制氯化氢,氢气在氯气中燃烧的现象是火焰呈苍白色,在集气瓶口有雾状物质出现,
故答案为:工业上制氯化氢;火焰呈苍白色,在集气瓶口有雾状物质出现;
(3)区别盐酸、氯化亚铁两种溶液最简单的方法是观察溶液的颜色,溶液为无色的为盐酸,呈淡绿色的为氯化亚铁,实验室检验氯化铁中所含的铁离子时,常在溶液中加入KSCN溶液,
故答案为:观察溶液的颜色,溶液为无色的为盐酸,呈淡绿色的为氯化亚铁;KSCN;
(4)反应①为钠和水的反应,生成氢氧化钠和氢气,反应离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(5)反应③是铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题是考查物质推断与性质、常用化学用语,难度中等,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识,注意特殊的颜色与特殊反应是推断的突破口.

| A. | BeCl2 | B. | H2O | C. | CH4 | D. | BF3 |
| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于$\frac{100}{ρ}$mL |
| A. | 用托盘天平称量25.20g NaCl | |
| B. | 用10mL量筒量取7.1mL稀盐酸 | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用浓度分别为0.50mol/L,体积各为50mL盐酸、氢氧化钠溶液测定中和热 |
| A. | 2摩 | B. | 2.5摩 | C. | 1.5摩 | D. | 3摩 |

 表示的分子式C6H14,结构简式(CH3)2CHCH2CH2CH3,名称是2-甲基戊烷.
表示的分子式C6H14,结构简式(CH3)2CHCH2CH2CH3,名称是2-甲基戊烷.