题目内容
硫化氢(H2S)是一种元色剧毒有臭鸡蛋气味的气体,蛋白质腐败和某些生命活动中均可以产生硫化氢,在工农业生产及科研活动中有重要的用途.
资料:①H2S可溶于水,其水溶液叫氢硫酸,是一种二元弱酸.
②FeS是一种不溶于水的黑褐色块状固体,能溶于盐酸或稀硫酸生成H2S.
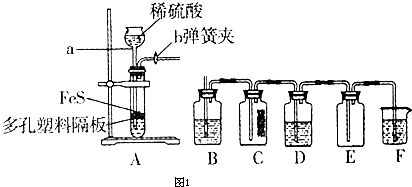
(1)某化学小组设计了制取少量H2S并验证其性质的实验,如图1所示.B中盛放CuSO4溶液,C中放有湿润的蓝色石蕊试纸,D中盛放FeCl3溶液.
请回答下列问题:
①装置A中仪器a的名称是 .写出装置A中发生反应的离子方程式 .
②B中有黑色沉淀产生,B中发生反应的化学方程式为 .工业上利用该反应检验Cu2+的存在,并使用H2S作为除去废水中某些重金属离子的沉淀剂.
③D中只有浅黄色沉淀产生,且溶液变浅绿色.写出发生反应的离子方程式 .检验溶液中的Fe3+已经反应完全的操作过程 .
(2)图2是实验室制取气体的常用反应器装置.

现在该小组在实验室中要用硫化亚铁和稀硫酸制备较大量的H2S气体,可选择装置 有同学选择了乙,请指出采用乙装置制取硫化氢气体的主要缺点 .
(3)为进一步探究-2价硫的化合物与+4价硫的化合物发生反应的条件,该小组同学又设计了下列实验.
①根据上述实验,可以得出结论:在 条件下,+4价硫的化合物可以氧化-2价硫的化合物.
②已知:电离平衡数:
H2S Ka1=1.3×10-7mol?L-1;Ka2=7.1×10-15mol?L-1
H2SO3 Ka1=1.7×10-2mol?L-1;Ka2=5.6×10-8mol?L-1
将SO2气体通入H2S水溶液中直至过量,图3表示溶液pH随SO2气体体积变化关系示意图正确的是 (填序号).
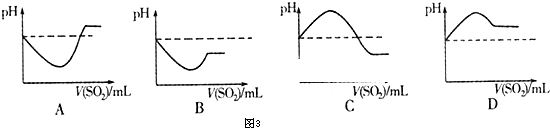
资料:①H2S可溶于水,其水溶液叫氢硫酸,是一种二元弱酸.
②FeS是一种不溶于水的黑褐色块状固体,能溶于盐酸或稀硫酸生成H2S.
(1)某化学小组设计了制取少量H2S并验证其性质的实验,如图1所示.B中盛放CuSO4溶液,C中放有湿润的蓝色石蕊试纸,D中盛放FeCl3溶液.

请回答下列问题:
①装置A中仪器a的名称是
②B中有黑色沉淀产生,B中发生反应的化学方程式为
③D中只有浅黄色沉淀产生,且溶液变浅绿色.写出发生反应的离子方程式
(2)图2是实验室制取气体的常用反应器装置.

现在该小组在实验室中要用硫化亚铁和稀硫酸制备较大量的H2S气体,可选择装置
(3)为进一步探究-2价硫的化合物与+4价硫的化合物发生反应的条件,该小组同学又设计了下列实验.
| 实验操作 | 实验现象 | |
| 实验l | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
②已知:电离平衡数:
H2S Ka1=1.3×10-7mol?L-1;Ka2=7.1×10-15mol?L-1
H2SO3 Ka1=1.7×10-2mol?L-1;Ka2=5.6×10-8mol?L-1
将SO2气体通入H2S水溶液中直至过量,图3表示溶液pH随SO2气体体积变化关系示意图正确的是
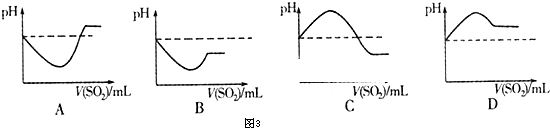
考点:性质实验方案的设计
专题:实验设计题
分析:(1)①装置A中仪器a的名称是长颈漏斗,写出装置A中发生反应FeS+H2SO4 =H2S↑+FeSO4;
②CuSO4与H2S反应生成CuS沉淀;
③FeCl3具有氧化性,与H2S发生氧化还原反应生成S和Fe2+;根据Fe3+的检验方法解答;
(2)根据硫化亚铁和稀硫酸制备大量硫化氢气体时反应物的状态和反应条件分析,固体和液体在常温下制取气体,最好选择装置丁,因为甲装置为加热固体,丙中反应容器小,只能制取少量气体;采用乙装置制取硫化氢气体的主要缺点 无法做到随开随用、随关随停,浪费药品,污染环境;
(3)①H2S与SO2发生氧化还原反应生成S;
②根据H2SO3 酸性比H2S强判断.
②CuSO4与H2S反应生成CuS沉淀;
③FeCl3具有氧化性,与H2S发生氧化还原反应生成S和Fe2+;根据Fe3+的检验方法解答;
(2)根据硫化亚铁和稀硫酸制备大量硫化氢气体时反应物的状态和反应条件分析,固体和液体在常温下制取气体,最好选择装置丁,因为甲装置为加热固体,丙中反应容器小,只能制取少量气体;采用乙装置制取硫化氢气体的主要缺点 无法做到随开随用、随关随停,浪费药品,污染环境;
(3)①H2S与SO2发生氧化还原反应生成S;
②根据H2SO3 酸性比H2S强判断.
解答:
解:(1)①装置A中仪器a的名称是长颈漏斗,写出装置A中发生反应FeS+H2SO4 =H2S↑+FeSO4,离子方程式FeS+2H++SO42-=H2S↑+Fe2++SO42-,故答案为:长颈漏斗;FeS+2H++SO42-=H2S↑+Fe2++SO42-;
②CuSO4与H2S反应生成CuS沉淀,反应的方程式为H2S+CuSO4=CuS↓+H2SO4,
故答案为:H2S+CuSO4=CuS↓+H2SO4;
③FeCl3具有氧化性,与H2S发生氧化还原反应生成S和Fe2+,反应的离子方程式为H2S+2Fe3+=S↓+2H++2Fe2+,检验溶液中的Fe3+已经反应完全的操作过程 取溶液少量置于试管中,滴加2-3滴KSCN溶液,若不变红色,说明Fe3+已经反应完全,
故答案为:H2S+2Fe3+=S↓+2H++2Fe2+;取溶液少量置于试管中,滴加2-3滴KSCN溶液,若不变红色,说明Fe3+已经反应完全;
(2)根据硫化亚铁和稀硫酸制备大量硫化氢气体时反应物的状态和反应条件分析,固体和液体在常温下制取气体,最好选择装置丁,因为甲装置为加热固体,丙中反应容器小,只能制取少量气体;采用乙装置制取硫化氢气体的主要缺点 无法做到随开随用、随关随停,浪费药品,污染环境,
故答案为:丁;无法做到随开随用、随关随停,浪费药品,污染环境;
(3)①由实验现象可知反应应下酸性条件下发生氧化还原反应生成S,故答案为:酸性(或酸性较强);
②H2SO3 酸性比H2S强,通入过量的SO2,溶液酸性更强,pH更小,故答案为:C.
②CuSO4与H2S反应生成CuS沉淀,反应的方程式为H2S+CuSO4=CuS↓+H2SO4,
故答案为:H2S+CuSO4=CuS↓+H2SO4;
③FeCl3具有氧化性,与H2S发生氧化还原反应生成S和Fe2+,反应的离子方程式为H2S+2Fe3+=S↓+2H++2Fe2+,检验溶液中的Fe3+已经反应完全的操作过程 取溶液少量置于试管中,滴加2-3滴KSCN溶液,若不变红色,说明Fe3+已经反应完全,
故答案为:H2S+2Fe3+=S↓+2H++2Fe2+;取溶液少量置于试管中,滴加2-3滴KSCN溶液,若不变红色,说明Fe3+已经反应完全;
(2)根据硫化亚铁和稀硫酸制备大量硫化氢气体时反应物的状态和反应条件分析,固体和液体在常温下制取气体,最好选择装置丁,因为甲装置为加热固体,丙中反应容器小,只能制取少量气体;采用乙装置制取硫化氢气体的主要缺点 无法做到随开随用、随关随停,浪费药品,污染环境,
故答案为:丁;无法做到随开随用、随关随停,浪费药品,污染环境;
(3)①由实验现象可知反应应下酸性条件下发生氧化还原反应生成S,故答案为:酸性(或酸性较强);
②H2SO3 酸性比H2S强,通入过量的SO2,溶液酸性更强,pH更小,故答案为:C.
点评:本题考查实验制备方案的设计,侧重于硫化氢的性质的设计,题目难度不大,注意把握实验原理和实验的基本操作方法的学习.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
131 55 |
| A、131 | B、76 | C、55 | D、21 |
下列表达正确的是( )
A、NaCl的电子式: |
B、CO2的分子模型示意图: |
C、CrO5的结构式为: 该氧化物中Cr为+6价 该氧化物中Cr为+6价 |
| D、次氯酸的结构式:H-Cl-O |
NH3和NO2在催化剂作用下反应:8NH3+6NO2→7N2+12H2O.若还原产物比氧化产物少0.1mol,则下列判断正确的是( )
| A、转移电子4.8NA个 |
| B、生成气体的体积42.56L(标准状况) |
| C、还原剂比氧化剂多0.2mol |
| D、被还原的氮原子是8.4g |
铁在下列情况下腐蚀最快的是( )
| A、将铁和锡连接后放入海水中 |
| B、铁放入海水中 |
| C、将铁和锌连接后放入海水中 |
| D、将铁和锌连接后放入淡水中 |
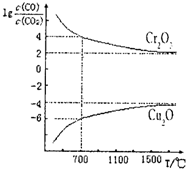 碳及其化合物有广泛用途.
碳及其化合物有广泛用途.