题目内容
 碳及其化合物有广泛用途.
碳及其化合物有广泛用途.(1)碳元素在周期表的位置是第
(2)已知:
C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H1=akJ/mol
C2H6(g)+
| 7 |
| 2 |
H2(g)+
| 1 |
| 2 |
写出乙烯与氢气发生加成反应的热化学方程式
(3)氰化物多数易溶于水,有剧毒,其中HCN是易挥发的弱酸[Ka(HCN)=6.17x10-10]
①若发生NaCN泄漏,常往受污染水域加入NaClO,将CN-氧化为两种常见的无毒气体
A.H2O2溶液 B.氯气 C.浓硝酸 D.KI
②处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),c(CN-)
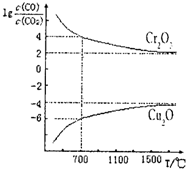
(4)一氧化碳可将金属氧化物还原为金属单质.如图是两种金属氧化物被一氧化碳还原时lg
| c(CO) |
| c(CO2) |
①CO(g)+Cu2O(s)═CO2(g)+2Cu(s)△H
②700℃时,反应3CO(g)+Cr2O3(s)═3CO2(g)+2Cr(s)的平衡常数K=
考点:化学平衡常数的含义,元素周期表的结构及其应用,反应热和焓变,热化学方程式
专题:基本概念与基本理论
分析:(1)C的原子结构中有2个电子层,最外层电子数为4;
(2)①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H1=akJ/mol
②C2H6(g)+
O2(g)═2CO2(g)+3H2O(l)△H2=bkJ/mol
③H2(g)+
O2(g)═H2O(l)△H3=ckJ/mol
由盖斯定律可知,①+③-②得C2H4(g)+H2(g)=C2H6(g);
(3)①NaClO将CN-氧化,C、N元素的化合价升高,具有强氧化性,且还原产物无毒物害可替代NaClO;
②处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),[Ka(HCN)=6.17×10-10,Kh=1.6×109,c(OH-)=10-5,则
=1.6×109;
(4)①由lg
与温度(T)的关系曲线可知,温度越大,比值越大,则升高温度,平衡逆向移动;
②700℃时,lg
=4,K=
.
(2)①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H1=akJ/mol
②C2H6(g)+
| 7 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知,①+③-②得C2H4(g)+H2(g)=C2H6(g);
(3)①NaClO将CN-氧化,C、N元素的化合价升高,具有强氧化性,且还原产物无毒物害可替代NaClO;
②处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),[Ka(HCN)=6.17×10-10,Kh=1.6×109,c(OH-)=10-5,则
| c(HCN)×10-5 |
| c(CN-) |
(4)①由lg
| c(CO) |
| c(CO2) |
②700℃时,lg
| c(CO) |
| c(CO2) |
| c3(CO2) |
| c3(CO) |
解答:
解:(1)C的原子结构中有2个电子层,最外层电子数为4,则C位于元素周期表第2周期第IVA族,故答案为:2;IVA;
(2)①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H1=akJ/mol
②C2H6(g)+
O2(g)═2CO2(g)+3H2O(l)△H2=bkJ/mol
③H2(g)+
O2(g)═H2O(l)△H3=ckJ/mol
由盖斯定律可知,①+③-②得C2H4(g)+H2(g)=C2H6(g),则△H=(a+c-b) kJ/mol,
所以热化学方程式为C2H4(g)+H2(g)=C2H6(g)△H=(a+c-b) kJ/mol,
故答案为:C2H4(g)+H2(g)=C2H6(g)△H=(a+c-b) kJ/mol;
(3)①NaClO将CN-氧化,C、N元素的化合价升高,则转化为无毒气体为N2、CO2,具有强氧化性,且还原产物无毒物害可替代NaClO,D具有还原性,BC为强氧化剂,氯气有毒,硝酸还原产物有毒,则最佳试剂为A,
故答案为:N2;CO2;A;
②处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),[Ka(HCN)=6.17×10-10,Kh=1.6×109,c(OH-)=10-5,则
=1.6×109,则c(CN-)<c(HCN),故答案为:<;
(4)①由lg
与温度(T)的关系曲线可知,温度越大,比值越大,则升高温度,平衡逆向移动,则△H<0,故答案为:<;
②700℃时,lg
=4,
=104,K=
=1×10-12,故答案为:1×10-12.
(2)①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H1=akJ/mol
②C2H6(g)+
| 7 |
| 2 |
③H2(g)+
| 1 |
| 2 |
由盖斯定律可知,①+③-②得C2H4(g)+H2(g)=C2H6(g),则△H=(a+c-b) kJ/mol,
所以热化学方程式为C2H4(g)+H2(g)=C2H6(g)△H=(a+c-b) kJ/mol,
故答案为:C2H4(g)+H2(g)=C2H6(g)△H=(a+c-b) kJ/mol;
(3)①NaClO将CN-氧化,C、N元素的化合价升高,则转化为无毒气体为N2、CO2,具有强氧化性,且还原产物无毒物害可替代NaClO,D具有还原性,BC为强氧化剂,氯气有毒,硝酸还原产物有毒,则最佳试剂为A,
故答案为:N2;CO2;A;
②处理含CN-废水时,用NaOH溶液调节至pH=9时(常温),[Ka(HCN)=6.17×10-10,Kh=1.6×109,c(OH-)=10-5,则
| c(HCN)×10-5 |
| c(CN-) |
(4)①由lg
| c(CO) |
| c(CO2) |
②700℃时,lg
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c3(CO2) |
| c3(CO) |
点评:本题考查较综合,涉及化学平衡常见的计算、平衡常数的含义、盖斯定律及计算等,侧重分析能力、计算能力的考查,注重高频考点的训练,题目难度较大,(3)中离子浓度比较为解答的难点.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2═CaCO3↓+H2O |
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸和烧碱溶液中和:H++OH-═H2O |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、3mol NO2与水充分反应,转移NA个电子 |
| B、0.1mol/L Na2SO4溶液中含有0.2NA个Na+ |
| C、常温常压下,17g NH3含有4NA个原子 |
| D、标准状况下,2.24L H2O含有0.1NA个水分子 |
下列在溶液可以大量共存的离子组是( )
| A、H+、Na+、NO3-、CO32- |
| B、Ba2+、Mg2+、Cl-、SO42- |
| C、H+、K+、OH-、NO3- |
| D、NO3-、SO42-、K+、Mg2+ |