题目内容
化学平衡问题研究对象主要是( )
| A、化学反应 | B、可逆反应 |
| C、离子反应 | D、气态物质的反应 |
考点:化学反应的可逆性
专题:化学平衡专题
分析:化学平衡问题研究对象主要是可逆反应,只有可逆反应最终进行的状态是达到化学平衡状态.
解答:
解:化学平衡问题研究对象主要是可逆反应,只有可逆反应最终进行的状态是达到化学平衡状态,不是可逆的化学反应不提化学反应的限度问题.
故选B.
故选B.
点评:注意可逆反应是化学平衡研究的方向,可逆反应存在反应的限度,注意知识点的理解和把握是关键,较基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在0.1mol/L的NH3?H2O溶液中存在如下电离平衡:NH3?H2O?NH4++OH-对于该平衡,下列叙述正确的是( )
| A、加入少量NaOH固体,溶液中c(OH-)减少 |
| B、通入少量HCl气体,平衡向正反应方向移动 |
| C、加水,反应速率增大,平衡向逆反应方向移动 |
| D、加入少量NH4Cl固体,平衡向正反应方向移动 |
下列叙述中正确的是( )
| A、将稀氨水逐滴加入硫酸当溶液的pH=7时,c(SO42-)>c(NH4+) | ||
| B、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1>10c2 | ||
| C、0.1mol/L的醋酸溶液加水稀释后,溶液中所有离子浓度都减小 | ||
D、向0.1mol?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
工业上用金红石(主要成分TiO2)制金属钛可通过以下反应进行:
①TiO2+2C+2Cl2
TiCl4+2CO ②TiCl4+2Mg
Ti+2MgCl2
对于上述两个反应的叙述正确的是( )
①TiO2+2C+2Cl2
| ||
| ||
| 加热 |
对于上述两个反应的叙述正确的是( )
| A、都是置换反应 |
| B、都是氧化还原反应 |
| C、反应中钛元素都被还原 |
| D、加热时金属钛和氩气(Ar)能反应 |
某有机化合物具有下列化学性质,则该有机化合物可能是( )
①能与钠反应放出气体 ②能使溴水褪色 ③能溶解氢氧化铜固体 ④能与碳酸钠固体反应放出气体.
①能与钠反应放出气体 ②能使溴水褪色 ③能溶解氢氧化铜固体 ④能与碳酸钠固体反应放出气体.
A、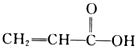 |
B、 |
| C、CH2=CH-CH2OH |
D、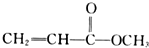 |
铊是超导材料的组成元素之一,铊在元素周期表中位于第六周期,与铝是同主族元素,元素符号是Tl.以下对铊的单质及其化合物的性质推断中,不正确的是( )
| A、铊是易导电的银白色金属 |
| B、铊能生成+3价的离子 |
| C、Tl3+的氧化能力比Al3+强 |
| D、氢氧化铊的碱性比氢氧化铝强 |
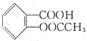 )在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:
)在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因: