题目内容
17.电子计算机所用钮扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应是:Zn+2OH--2e═ZnO+H2O和Ag2O+H2O+2e═2Ag+2OH-;下列判断正确的是( )| A. | 锌为正极,Ag2O为负极 | B. | 锌为负极,Ag2O为正极 | ||
| C. | 原电池工作时,Ag2O发生氧化反应 | D. | 原电池工作时,负极区溶液PH增大 |
分析 根据化合价变化可知Zn被氧化,发生氧化反应,应为原电池的负极,则正极为Ag2O,得电子发生还原反应;根据电极反应判断溶液pH的变化.
解答 解:A.根据化合价变化可知Zn被氧化,应为原电池的负极,则正极为Ag2O,故A错误;
B.根据化合价变化可知Zn失电子被氧化,为原电池的负极,正极为Ag2O,故B正确;
C.正极为Ag2O,得电子发生还原反应,故C错误;
D.原电池工作时,负发生反应Zn+2OH--2e-=ZnO+H2O,溶液PH值减小,故D错误.
故选B.
点评 本题考查了原电池知识,题目难度不大,注意根据正负极发生的反应来判断溶液的PH的变化,明确原电池原理是解答该题的关键.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
8.合物Z由如下反应得到:C4H9Br$→_{NaOH}^{醇,△}$Y$→_{CCl_{4}}^{Br_{2}}$Z,Z的结构简式不可能是( )
| A. | CH3CH(CH2Br)2 | B. | CH3CH2CHBrCH2Br | C. | H3CHBrCHBrCH3 | D. | CH2BrCBr(CH3)2 |
5.A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子总数比A原子核外电子总数多5个电子,则A、B可形成的化合物为( )
| A. | A2B | B. | AB2 | C. | B2A3 | D. | B3A2 |
2.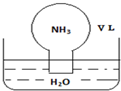 标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )
 标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )
标准状况下,将体积为V L的圆底烧瓶中充满氨气,倒扣在含有足量水的水槽中(如图所示),实验完毕后立即将烧瓶从水槽中取出,所得溶液的密度为ρg•cm-3.下列说法正确的是( )| A. | 条件不足,不能计算所得溶液的物质的量浓度 | |
| B. | 所得溶液中,n(NH3•H2O)+n(NH4+)=$\frac{V}{22.4}$ mol | |
| C. | 所得溶液的质量分数为$\frac{17}{22400}$ρ | |
| D. | 水最终不可能充满整个烧瓶 |
9.下列物质:①乙烯②乙炔③甲烷④四氯化碳,其中分子具有正四面体型的是( )
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ③④ |
6.漂白粉在空气中易失效的原因是( )
| A. | CaCl2易吸收空气中的水分 | |
| B. | Ca(ClO)2见光易分解 | |
| C. | Ca(ClO)2与空气中的水分和二氧化碳作用,生成HClO | |
| D. | Ca(ClO)2易被空气中的氧气氧化 |
7.下列化学用语正确的是( )
| A. | 氮分子的电子式: | B. | 硫原子的结构示意图: | ||
| C. | 溴化钠的电子式: | D. | 水分子的结构式:H-O-H |

 ,I
,I .
. ;D→G
;D→G ;E与新制银氨溶液反应
;E与新制银氨溶液反应 .
.