题目内容
20.下列物质的工业生产过程中,其主要反应不涉及氧化还原反应的是( )| A. | 生铁 | B. | 硫酸 | C. | 烧碱 | D. | 纯碱 |
分析 有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化,据此分析.
解答 解:A.冶炼铁,发生的反应Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,化合价发生变化,为氧化还原反应,故A不选;
B.硫酸工业中存在S~SO2~SO3的转化,化合价发生变化,为氧化还原反应,故B不选;
C.涉及的反应为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH,该反应中有电子的转移,属于氧化还原反应,故C不选;
D.氨碱法生产纯碱涉及的方程式为:NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,这几个方程式中都没有电子的转移,所以不涉及氧化还原反应,故D选;
故选D.
点评 本题考查氧化还原反应、化学工业原理,明确各工业生成原理是解本题关键,难度不大,侧重于考查学生对基础知识的应用能力,注意把握反应原理、结合元素的化合价的变化分析.

练习册系列答案
相关题目
10.碳是构成地球生命的重要元素.下列说法正确的是( )
| A. | 自然界中不存在游离态的碳 | B. | 碳的化合物数量众多,分布极广 | ||
| C. | 向空气中排放二氧化碳会形成酸雨 | D. | 煤、石油、天然气属于可再生碳资源 |
11.为实现实验目的,选用的装置、实验操作均正确的是( )
| 实验目的 | 实验步骤和装置 | |
| A | 探究温度对反应速率的影响 | 不同温度下,分别取同体积0.1mol•L-1KI溶液,向其中匀先加入淀粉溶液3滴,再各加入0.1mol•L-1硫酸5滴,并同时记录溶液出现蓝色的时间 |
| B | 配制100mL1.0mol•L-1NaOH溶液 | 向100mL容量瓶中加入4.0gNaOH固体,加水到刻度线 |
| C | 验证牺牲阳极的阴极保护法 | 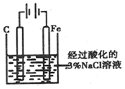 往铁电极附近滴加铁氯化钾溶液 |
| D | 比较H2O2和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
8.下列关于有机物的说法正确的是( )
| A. | 乙醇、乙酸均能与NaOH溶液反应 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 通过乙烯的取代反应可制得氯乙烷 | |
| D. | C4H8Cl2有9种同分异构体 |
15.紫苏醇可抑制肿瘤发生,其结构简式如图,下列有关紫苏醇的叙述正确的是( )
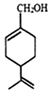

| A. | 分子式为C10H16O | |
| B. | 紫苏醇为芳香族化合物 | |
| C. | 环上的一氯取代物有四种 | |
| D. | 使酸性高锰酸钾溶液和溴水褪色的原理相同 |
5.下列调味品的主要成分属于无机物的是( )
| A. | 食醋 | B. | 料酒 | C. | 食盐 | D. | 麻油 |
12.等量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的物质的量之比是( )
| A. | 1:1 | B. | 3:4 | C. | 2:3 | D. | 4:3 |
13.电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理.下列说法正确的是( )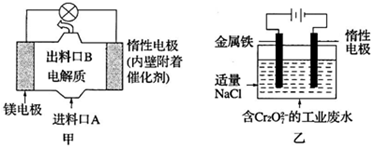

| A. | 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中惰性电极棒上有O2放出 | |
| C. | 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 | |
| D. | 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应 |
14.下列说法正确的是( )
| A. | 甲烷与氯气取代反应的产物二氯代甲烷无同分异构体说明甲烷是正四面体结构 | |
| B. | 等物质的量的乙烷与乙酸完全燃烧消耗氧气的量相等 | |
| C. | 按系统命名法,化合物  的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| D. | 结构简式为  的化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 的化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |