题目内容
1.对于合成氨反应,达到平衡后,以下分析正确的是( )| A. | 升高温度,对正反应的反应速率影响更大 | |
| B. | 增大压强,对正反应的反应速率影响更大 | |
| C. | 减小反应物浓度,对逆反应的反应速率影响更大 | |
| D. | 加入催化剂,对逆反应的反应速率影响更大 |
分析 A、合成氨是发热反应,升温平衡逆向进行;
B、反应是气体体积减小的反应,增大压强平衡正向进行;
C、减小反应物浓度,平衡逆向进行;
D、催化剂同等程度影响正逆反应速.
解答 解:合成氨的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,△H<0,反应是气体体积减小的发热反应,
A、合成氨是放热反应,升温平衡逆向进行,对逆反应的反应速率影响更大,故A错误;
B、反应是气体体积减小的反应,增大压强平衡正向进行,对正反应的反应速率影响更大,故B正确;
C、减小反应物浓度,平衡逆向进行,正反应减小的多,对正反应的反应速率影响更大,故C错误;
D、催化剂改变反应速率,不改变化学平衡,同等程度影响正逆反应速率,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素分析判断,主要是费用特征和平衡移动原理的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.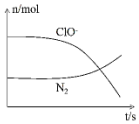 某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
 某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是( )| A. | 该反应中Cl-为氧化产物 | B. | 消耗1 mol还原剂,转移6 mol电子 | ||
| C. | 反应后溶液的酸性减弱 | D. | NH4+被ClO-氧化成N2 |
8.下列关于有机物的说法正确的是( )
| A. | 乙醇、乙酸均能与NaOH溶液反应 | |
| B. | 糖类、油脂、蛋白质均能发生水解反应 | |
| C. | 通过乙烯的取代反应可制得氯乙烷 | |
| D. | C4H8Cl2有9种同分异构体 |
5.下列调味品的主要成分属于无机物的是( )
| A. | 食醋 | B. | 料酒 | C. | 食盐 | D. | 麻油 |
12.等量的铁粉分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的物质的量之比是( )
| A. | 1:1 | B. | 3:4 | C. | 2:3 | D. | 4:3 |
13.电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理.下列说法正确的是( )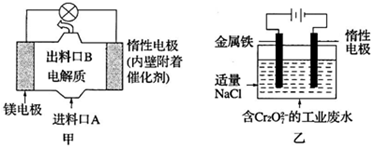

| A. | 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中惰性电极棒上有O2放出 | |
| C. | 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 | |
| D. | 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应 |
11.可逆反应N2+3H2$?_{催化剂}^{高温高压}$2NH3,在体积不变的密闭容器中反应,达到平衡状态的标志是( )
| A. | 单位时间内生成n molN2的同时生成n molNH3 | |
| B. | N2、H2、NH3的物质的量浓度比值为1:3:2 | |
| C. | v(N2)=v(NH3) | |
| D. | 单位时间内断裂1mol氮氮键的同时断裂6mol氮氢键 |
