题目内容
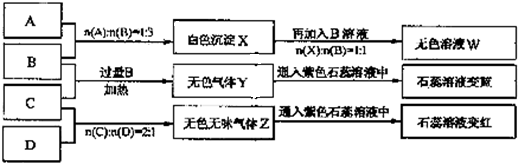
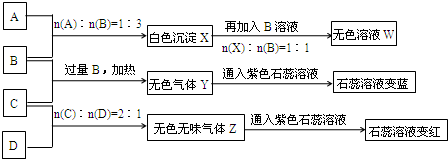
现有![]() 四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):
四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):

(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为 、 。
(2)D溶液pH (填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)
。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4):前者 后![]() 者(填“<”“>”“=”)。
者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是
(1)AlCl3 ;Na[Al(OH)4
(2)大于;![]()
(3)NaOH> Na2CO3> AlCl3> NH4HSO4
(4)>
(5)![]() >
>![]() >
>![]() >
>![]() =
=![]()
解析:
由A、B反应流程图及比例关系可推A为AlCl3,B为NaOH,由B、C反应流程图知,Y为NH3,C应该为铵盐,所以C为NH4HSO4,D就为Na2CO3气体Z为CO2。
⑴A是AlCl3,AlCl3水解:![]() ,灼烧:
,灼烧:![]() ;AlCl3水解产物受热分解得到的是Al2O3和HCl,最后HCl完全逸到空气中;W是Na[Al(OH)4],水解
;AlCl3水解产物受热分解得到的是Al2O3和HCl,最后HCl完全逸到空气中;W是Na[Al(OH)4],水解![]() ,由于OH-的存在,Al(OH)3不能沉淀下来,最后得到Na[Al(OH)4]。
,由于OH-的存在,Al(OH)3不能沉淀下来,最后得到Na[Al(OH)4]。
⑵D是Na2CO3,由于![]() 水解:
水解:![]() 而呈碱性,故pH>7。
而呈碱性,故pH>7。
⑶A、B、C、D四种溶液,其中NaOH和Na2CO3呈碱性的pH>7,而且NaOH碱性>Na2CO3,AlCl3和NH4HSO4呈酸性,pH<7,NH4HSO4酸性>AlCl3,所以等物质的量浓度A、B、C、D的pH由大到小的顺序是NaOH> Na2CO3> AlCl3> NH4HSO4
⑷等物质的量浓度的NH4HSO4与NH4Cl溶液,NH4HSO4电离出的H+对![]() 的水解起到抑制作用,所以
的水解起到抑制作用,所以![]() :前者>后者。
:前者>后者。
⑸混合溶液呈中性,则![]() =
=![]() ,由电荷守恒有
,由电荷守恒有![]() >
>![]() >
>![]() >
>![]() =
=![]()