题目内容
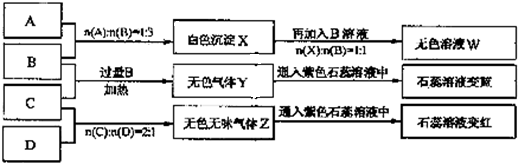
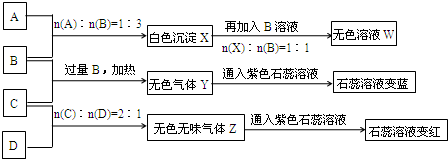
现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验.实验过程和记录如图所示(无关物质已经略去):

请回答:
(1)A的溶液加热蒸干并灼烧最后所得固体为
(2)D溶液pH
(3)等物质的量浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是

请回答:
(1)A的溶液加热蒸干并灼烧最后所得固体为
Al2O3
Al2O3
(填化学式).(2)D溶液pH
大于
大于
(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.(3)等物质的量浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者
>
>
后者(填“<”、“>”或“=”)(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是
C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-)
C(Na+)>C(SO42-)>C(NH4+)>C(H+)=C(OH-)
.分析:由A、B反应流程图及比例关系可推A为AlCl3,B为NaOH,由B、C反应流程图知,Y为NH3,C应该为铵盐,所以C为NH4HSO4,D就为Na2CO3气体,Z为CO2,
(1)加热促进盐类的水解,根据盐类水解原理分析;
(2)根据盐的水解条件以及水解规律来回答;
(3)从盐类水解的影响因素以及平衡移动的角度分析;
(4)从溶液电荷守恒的角度分析.
(1)加热促进盐类的水解,根据盐类水解原理分析;
(2)根据盐的水解条件以及水解规律来回答;
(3)从盐类水解的影响因素以及平衡移动的角度分析;
(4)从溶液电荷守恒的角度分析.
解答:解:由A、B反应流程图及比例关系可推A为AlCl3,B为NaOH,由B、C反应流程图知,Y为NH3,C应该为铵盐,所以C为NH4HSO4,D为Na2CO3,气体Z为CO2,
(1)A是AlCl3,AlCl3水解:Al3++3H2O?Al(OH)3+3H+,灼烧发生2Al(OH)3
Al2O3+3H2O;AlCl3水解产物受热分解得到的是Al2O3和HCl,最后HCl完全逸到空气中,最后所得固体为Al2O3,故答案为:Al2O3;
(2)D是Na2CO3,由于CO32-水解:CO32-+H2O?HCO3-+OH-而呈碱性,故pH>7,
故答案为:大于;CO32-+H2O?HCO3-+OH-;
(3)等物质的量浓度的NH4HSO4与NH4Cl溶液,NH4HSO4电离出的H+对NH4+的水解起到抑制作用,所以c(NH4+):前者>后者,故答案为:>;
(4)B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中存在硫酸钠、硫酸铵以及氨水等溶质,混合溶液呈中性,则c(H+)=c(OH-),由电荷守恒有c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-).
(1)A是AlCl3,AlCl3水解:Al3++3H2O?Al(OH)3+3H+,灼烧发生2Al(OH)3
| ||
(2)D是Na2CO3,由于CO32-水解:CO32-+H2O?HCO3-+OH-而呈碱性,故pH>7,
故答案为:大于;CO32-+H2O?HCO3-+OH-;
(3)等物质的量浓度的NH4HSO4与NH4Cl溶液,NH4HSO4电离出的H+对NH4+的水解起到抑制作用,所以c(NH4+):前者>后者,故答案为:>;
(4)B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中存在硫酸钠、硫酸铵以及氨水等溶质,混合溶液呈中性,则c(H+)=c(OH-),由电荷守恒有c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-),
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-).
点评:本题考查物质的检验及鉴别,题目难度中等,本题侧重于盐类的水解考查,学习中注意把握相关知识.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目