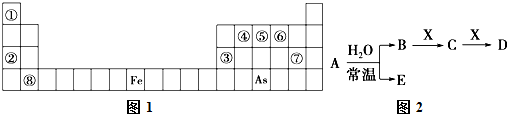
题目内容
下列事实中,能用化学平衡移动原理来解释的是( )
| A、加入催化剂有利于合成氨的反应 |
| B、对于反应2HI(g)?H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 |
| C、500℃左右比室温更有利于合成氨反应 |
| D、高压条件有利于合成氨反应 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答:
解:A、加入催化剂有利于合成氨的反应,催化剂使用平衡不移动,不能用化学平衡移动原理解释,故A不符合;
B、对于反应2HI(g)?H2(g)+I2(g),增大平衡体系的压强平衡不移动,不能用化学平衡移动原理解释,故B不符合;
C、合成氨反应是放热反应,升高温度平衡不移动,不能用化学平衡移动原理解释的,故C不符合;
D、合成氨反应是气体积缩小的反应,增大压强平衡正向移动,能用化学平衡移动原理解释的,故D符合;
故选D.
B、对于反应2HI(g)?H2(g)+I2(g),增大平衡体系的压强平衡不移动,不能用化学平衡移动原理解释,故B不符合;
C、合成氨反应是放热反应,升高温度平衡不移动,不能用化学平衡移动原理解释的,故C不符合;
D、合成氨反应是气体积缩小的反应,增大压强平衡正向移动,能用化学平衡移动原理解释的,故D符合;
故选D.
点评:本题考查了勒夏特列原理的使用条件,难度不大,注意把握影响平衡移动的因素以及使用勒夏特列原理的前提.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
标准状况下的28L NH3溶于125mL水中,若所得氨水的密度近似为1g?cm-3,则下列说法正确的是( )
A、物质的量浓度(mol?L-1)与溶液质量分数、密度(g?cm-3)的关系为:c=
| ||
| B、此氨水中NH3的物质的量浓度近似为9.9 mol?L-1 | ||
| C、此氨水中NH3的物质的量浓度近似为8.55 mol?L-1 | ||
| D、此氨水中NH3的质量分数为0.17 |
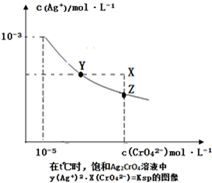 已知t℃时AgCl的Ksp=4×10-l0,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-l0,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )| A、在t℃时,Ag2CrO4的Ksp为1×10-11 |
| B、在饱和溶液中加入K2CrO4可使溶液由Y点到Z点 |
| C、在t℃时,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107 |
| D、在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混和溶液,CrO42-先沉淀 |
某混合气体是由HF、(HF)2、(HF)3三种气体组成,该混合气体的平均相对分子质量为38,则混合气体中HF的体积分数为( )
| A、大于10% | B、小于10% |
| C、等于10% | D、无法计算 |
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
| A、上层为无色,下层为紫红色 |
| B、整个溶液变为棕黄色 |
| C、整个溶液变紫色 |
| D、下层无色,上层紫红色 |
将4.6g Na投入到95.6g水中,所得溶液中溶质的质量分数为( )
| A、小于4.6% |
| B、等于8.0% |
| C、小于8.0% |
| D、大于8.0% |