题目内容
下表图1是元素周期表的一部分.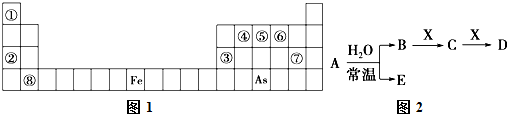
已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图2所示的转化关系(部分生成物和反应条件已略去):
(1)⑧的元素符号是 .
(2)⑤与As两种元素中,非金属性较强的是 (填元素符号).
(3)若E为氧化物,则A、X的化学式分别为 、 .
(4)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂.As可与Y的碱性溶液反应,当消耗1mol还原剂时,消耗2.5mol氧化剂,转移5mol电子.该反应的离子方程式为 .

已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图2所示的转化关系(部分生成物和反应条件已略去):
(1)⑧的元素符号是
(2)⑤与As两种元素中,非金属性较强的是
(3)若E为氧化物,则A、X的化学式分别为
(4)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂.As可与Y的碱性溶液反应,当消耗1mol还原剂时,消耗2.5mol氧化剂,转移5mol电子.该反应的离子方程式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)根据元素周期表,可确定①为H、②为Na、③为Al、④为C、⑤为N、⑥为O、⑦为Cl、⑧为Ca;
(2)⑤是N元素,与As在同一主族,根据同主族元素由上到下非金属性减弱;
(3)A在常温下与水反应生成氧化物,可确定A是NO2,E是NO,则X是Fe;
(4)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂,则Y为NaClO,当消耗1 mol还原剂时,消耗2.5 mol氧化剂,转移5 mol电子,说明生成物中As元素的化合价为+5,Cl元素的化合价为-1,由此可写出离子方程式.
(2)⑤是N元素,与As在同一主族,根据同主族元素由上到下非金属性减弱;
(3)A在常温下与水反应生成氧化物,可确定A是NO2,E是NO,则X是Fe;
(4)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂,则Y为NaClO,当消耗1 mol还原剂时,消耗2.5 mol氧化剂,转移5 mol电子,说明生成物中As元素的化合价为+5,Cl元素的化合价为-1,由此可写出离子方程式.
解答:
解:根据元素周期表,可确定①为H、②为Na、③为Al、④为C、⑤为N、⑥为O、⑦为Cl、⑧为Ca;
(1)根据元素周期表可确定⑧是钙,元素符号为Ca,故答案为:Ca;
(2)⑤是N,与As在同一主族,根据同主族元素由上到下非金属性减弱,所以非金属性较强的是N,故答案为:N;
(3)A在常温下与水反应生成氧化物,可确定A是NO2,E是NO,则X是Fe,故答案为:NO2;Fe;
(4)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂,则Y为NaClO,当消耗1 mol还原剂时,消耗2.5 mol氧化剂,转移5 mol电子,说明生成物中As元素的化合价为+5,Cl元素的化合价为-1,该反应离子方程式为:5ClO-+2As+6OH-═2AsO43-+5Cl-+3H2O,故答案为:5ClO-+2As+6OH-═2AsO43-+5Cl-+3H2O.
(1)根据元素周期表可确定⑧是钙,元素符号为Ca,故答案为:Ca;
(2)⑤是N,与As在同一主族,根据同主族元素由上到下非金属性减弱,所以非金属性较强的是N,故答案为:N;
(3)A在常温下与水反应生成氧化物,可确定A是NO2,E是NO,则X是Fe,故答案为:NO2;Fe;
(4)Y由②⑥⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂,则Y为NaClO,当消耗1 mol还原剂时,消耗2.5 mol氧化剂,转移5 mol电子,说明生成物中As元素的化合价为+5,Cl元素的化合价为-1,该反应离子方程式为:5ClO-+2As+6OH-═2AsO43-+5Cl-+3H2O,故答案为:5ClO-+2As+6OH-═2AsO43-+5Cl-+3H2O.
点评:本题考查元素周期表与元素周期律、无机物推断、氧化还原反应、离子方程式等,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2 固体的量减少,须加入少量的( )
| A、NH4Cl |
| B、NaOH |
| C、MgSO4 |
| D、NaNO3 |
家用炒菜锅用水清洗后,出现红棕色的锈斑.在此变化过程中不发生的化学反应是( )
| A、4Fe(OH)2+2H2O+O2═4Fe(OH)3 |
| B、2Fe+2H2O+O2═2Fe(OH)2 |
| C、正极反应:2H2O+O2+4 e-→4OH- |
| D、负极反应:Fe→Fe3++3 e- |
下列化合物属于弱电解质的是( )
| A、醋酸 |
| B、Ba(OH)2 |
| C、CO2 |
| D、HF |
下列事实中,能用化学平衡移动原理来解释的是( )
| A、加入催化剂有利于合成氨的反应 |
| B、对于反应2HI(g)?H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 |
| C、500℃左右比室温更有利于合成氨反应 |
| D、高压条件有利于合成氨反应 |
对危险化学品要在包装标签上印上警示性标志.下列化学药品名称与警示标志名称对应正确是( )
| A、酒精--剧毒品 |
| B、浓硫酸-腐蚀品 |
| C、汽油--自燃物品 |
| D、烧碱--剧毒品 |