题目内容
11.X、Y、Z、M、Q、R是六种短周期元素,其原子半径及主要化合价如表:| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
| A. | Z、Q均为ⅣA族元素 | |
| B. | X、Y、M三种元素中金属性最强的是M | |
| C. | R、Z形成的R2Z分子是非极性分子 | |
| D. | M的氢氧化物和Y的氢氧化物都能与氢氧化钠溶液反应 |
分析 短周期元素,由元素的化合价可知,Z、Q均有-2价,且Z有+6价,原子半径较大,故Q为O元素、Z为S元素;X、M均有+2价,处于ⅡA族,且X原子半径较大,故X为Mg、M为Be;R为+1价,原子半径小于O,故R为H元素;Y有+3价,处于ⅢA族,原子半径大于S,故Y为Al,据此解答.
解答 解:短周期元素,由元素的化合价可知,Z、Q均有-2价,且Z有+6价,原子半径较大,故Q为O元素、Z为S元素;X、M均有+2价,处于ⅡA族,且X原子半径较大,故X为Mg、M为Be;R为+1价,原子半径小于O,故R为H元素;Y有+3价,处于ⅢA族,原子半径大于S,故Y为Al.
A.Z、Q均为VIA族元素,故A错误;
B.同周期自左而右金属性减弱,同主族自上而下金属性增强,故Mg的金属性最强,故B错误;
C.R、Z形成的H2S分子为V形结构,分子中正负电荷重心不重合,属于极性分子,故C错误;
D.Be、Al处于对角线位置,它们氢氧化物的性质相似,均为两性氢氧化物,能与氢氧化钠溶液反应,故D正确,
故选:D.
点评 本题考查结构性质位置关系应用,关键是根据化合价与原子半径推断元素,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
1.下列反应属于吸热反应的是( )
| A. | 碳在氧气中的燃烧 | B. | 葡萄糖在人体内氧化分解 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 锌粒与稀H2SO4反应制取H2 |
2.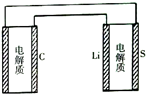 已知:锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
 已知:锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂离子电池放电时,负极反应为:6C+xLi++xe-═LixC6 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 如图表示用锂硫电池给锂离子电池充电 |
19.下列实验操作与实验现象和实验结论正确的是( )
| 选项 | 实验 | 实验现象 | 实验结论 |
| A | 取少量食盐溶于水,加稀硫酸酸化再滴入淀粉溶液 | 溶液呈蓝色 | 食盐为加碘食盐 |
| B | 取两支试管,都加入2mL0.01mol/L的酸性KMnO4溶液,向其中一支试管加入2mL蒸馏水后,再同时向两支试管各加入2mL0.1mol/L的H2C2O4溶液 | 两试管中溶液紫色均褪去,且后者所用时间更短 | 酸性KMnO4溶液浓度越大,化学反应速率越快 |
| C | 向蛋白质溶液中加入CuCl2或 (NH4)2SO4饱和溶液 | 均有沉淀 | 蛋白质均发生了变性 |
| D | 将0.1mol/L MgSO4溶液滴入NaOH稀溶液至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
16.下列描述正确的是( )
| A. | 16O→18O的转化属于化学变化 | |
| B. | 冰醋酸、消石灰、明矾、生石灰分别属于酸、碱、盐、氧化物 | |
| C. | SiO2既能与氢氟酸反应,也能与氢氧化钠溶液反应,属于两性氧化物 | |
| D. | 少量Cu将足量浓、稀硝酸分别还原为NO2和NO,其转移电子数之比为1:3 |
20.短周期元素W、X、Y、Z 的原子序数依次增大,W的单质是空气中体积分数最大的气体,W与Y最外层电子数之和为X最外层电子数的2倍,X、Y、Z简单离子的电子层结构相同,Z最外层电子数等于最内层电子数.下列说法正确的是( )
| A. | 元素非金属性由强到弱的顺序:Y、X、W | |
| B. | W的简单气态氢化物比Y的简单气态氢化物稳定 | |
| C. | 原子半径由大到小的顺序:Z、Y、X、W | |
| D. | WX与ZX中的化学键类型相同 |
3.已知反应:①MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,②Cu+2Fe3+═Cu2++2Fe2+,③Cl2+2Fe2+═2Cl-+2Fe3+.则有关物质(离子)的氧化性由强到弱的顺序为( )
| A. | Cl2>Fe3+>Cu2+>MnO2 | B. | MnO2>Cl2>Fe3+>Cu2+ | ||
| C. | Fe3+>Cu2+>MnO2>Cl2 | D. | Cu2+>Fe3+>Cl2>MnO2 |