题目内容
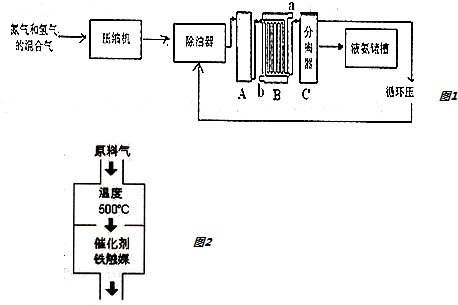
5.工业上常采用固体碱熔氧化法用铬铁矿粉 制备重铬酸钾,铬铁矿的主要成分为 FeO•Cr2O3,还含 有 SiO2、Al2O3 等杂质.实验室现欲模拟此过程,具体流 程如下:
已知:①NaFeO2 遇水强烈水解;②重铬酸钾为橙红色三斜晶体或针状晶体,溶于水,不溶于乙醇,有 强氧化性;③2CrO4 2-+2H+?Cr2O7 2-+H2O.请回答以下问题:
(1)灼烧操作一般在坩埚中进行,下列物质适合用来制作此实验坩埚材料的是A
A.铁 B.氧化铝 C.石英 D.陶瓷
(2)铬铁矿经粉碎处理的目的是增大反应物的表面积,加快反应速率
(3)滤渣 1 为红褐色固体,滤液 1 的成分除 Na2CrO4、NaOH 外,还含有(填化学式) 实验中将滤液 1 调节 pH=7~8 的目的是促进AlO2-、和SiO32-水解转化为Al(OH)3、H2SiO3沉淀.
(4)通过途径 I 从 Na2CrO4溶液中获得 K2Cr2O7晶体,必须进行的操作步骤有:酸化→加 KCl 固体→蒸发 浓缩→操作 a→过滤→洗涤→干燥.
①“酸化”操作时可选择的酸是稀硫酸
②操作 a 的名称是冷却结晶.在此步操作过程中如果溶液出现过饱和现象,可采用加入晶体、摩擦烧杯壁或用玻璃棒搅拌等方法促进晶体析出.
(5)已知实验取用的铬铁矿 38.0g,其中含 Cr2O340%,最终获 得 K2Cr2O7 晶体 20.9g,则产率为71.1%.
分析 铬铁矿主要成分为FeO•Cr2O3,含有SiO2、Al2O3等杂质、混和NaOH,与足量空气煅烧,4FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;煅烧\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O,生成Na2CrO4、NaFeO2、Na2SiO3、NaOH和NaAlO2的混合体系,然后加水溶解,三价铁水解,NaFeO2+2H2O=Fe(OH)3↓+NaOH,得固体氢氧化铁滤渣1和滤液Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全沉淀;过滤,使滤液酸化,使CrO42-转化为Cr2O72-,2CrO42-+2H+?Cr2O72-+H2O,加KCl固体→蒸发浓缩→冷却结晶→过滤→洗涤→干燥,得到K2Cr2O7.
(1)根据步骤①在坩埚中进行煅烧物质含有强碱氢氧化钠,氢氧化钠能和二氧化硅反应来解答;
(2)根据影响化学反应速率的常见因素进行解答;
(3)根据流程分析样品中含有SiO2、Al2O3等杂质在NaOH溶液里会溶解生成可溶性盐进入滤液I;调节溶液pH的目的是为了除去滤液Ⅰ中含有的杂质离子,使之水解转化为沉淀除去;
(4)①为使2CrO42-+2H+?Cr2O72-+H2O 的平衡向正反应方向移动,可选择非氧化性或还原性的酸酸化;
②从溶液中提取溶质的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,过饱和溶液中促进晶体析出的方法是提供晶体核即可;
(5)可根据原子守恒计算出K2Cr2O7 晶体理论产量,再利用K2Cr2O7 晶体实际产量与理论产量的比值计算出产率.
解答 解:铬铁矿主要成分为FeO•Cr2O3,含有SiO2、Al2O3等杂质、混和NaOH,与足量空气煅烧,4FeO•Cr2O3+7O2+20NaOH$\frac{\underline{\;煅烧\;}}{\;}$8Na2CrO4+4NaFeO2+10H2O,生成Na2CrO4、NaFeO2、Na2SiO3、NaOH和NaAlO2的混合体系,然后加水溶解,三价铁水解,NaFeO2+2H2O=Fe(OH)3↓+NaOH,得固体氢氧化铁滤渣1和滤液Na2CrO4、Na2SiO3、NaOH、NaAlO2,再调节溶液的pH,使偏铝酸盐完全转化为氢氧化铝沉淀,硅酸盐完全沉淀;过滤,使滤液酸化,使CrO42-转化为Cr2O72-,2CrO42-+2H+?Cr2O72-+H2O,加KCl固体→蒸发浓缩→冷却结晶→过滤→洗涤→干燥,得到K2Cr2O7.
(1)A.铁坩埚含有铁,铁与氢氧化钠不反应,故A正确;
B.三氧化二铝能和氢氧化钠反应生成偏铝酸钠,故B错误;
C.石英中含有二氧化硅,二氧化硅能和氢氧化钠反应,故C错误;
D.陶瓷中含有二氧化硅,二氧化硅能和氢氧化钠反应,故D错误;
故答案为:A;
(2)固体的表面积越大,反应速率越大,铬铁矿经粉碎处理,能使铬铁矿的表面积增大,增大了与氧气 接触面积,所以反应速率加快;
故答案为:增大反应物的表面积,加快反应速率;
(3)由流程分析可知滤液I中含有Na2CrO4、NaFeO2、Na2SiO3、NaOH和NaAlO2,调节溶液的pH=7~8 的目的是促进AlO2-、和SiO32-水解转化为Al(OH)3、H2SiO3沉淀,通过过滤除去;故答案为:NaAlO2、Na2SiO3;促进AlO2-、和SiO32-水解转化为Al(OH)3、H2SiO3沉淀;
(4)①“酸化”步骤用稀硫酸来调节溶液pH<5,促进CrO42-转化为Cr2O72-,故答案为:稀硫酸;
②从溶液中提取溶质的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,则操作a为冷却结晶,促进过饱和溶液析出晶体,可通过加入晶体、摩擦烧杯壁或用玻璃棒搅拌等方法找一个“中心”聚集起来让晶体析出,故答案为:冷却结晶;加入晶体、摩擦烧杯壁或用玻璃棒搅拌;
(5)铬铁矿38.0g,其中含 Cr2O340%,可知Cr2O3质量为38.0×40%=15.2g,物质的量为$\frac{15.2g}{152g/mol}$=0.1mol,根据原子守恒,理论得到的K2Cr2O7 晶体物质的量为0.1mol,质量为0.1mol×294g/mol=29.4g,最终获 得 K2Cr2O7 晶体 20.9g,则产率为$\frac{20.9g}{29.4g}×100%$=71.1%.
点评 本题考查了物质制备实验方案的流程分析和产物判断,题目难度中等,把握生产流程是解题的关键,注意物质之间的转化,侧重于考查学生的实验探究能力和对基础知识的综合应用能力.

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案| A. | 12.5mL 16mol•L-1浓硫酸与足量锌反应,转移电子数为0.2NA | |
| B. | 1.8gNH4+与2.3gNa+所含电子数目均为NA | |
| C. | 7.8 gNa2S固体和7.8 gNa2O2固体中含有的阴离子数目均为0.1 NA | |
| D. | 常温常压下,92 gNO2和N2O4混合气体含有的原子数为6NA |
| A. | 淀粉和纤维素都是纯净物 | |
| B. | 油脂不是高分子化合物 | |
| C. | 植物油不能使溴的四氯化碳溶液褪色 | |
| D. | 糖类物质均有甜味 |
| A. |  | B. |  | C. |  | D. |  |

| A. | 原子半径 | B. | 氢化物的稳定性 | C. | 电子层数 | D. | 单质的熔沸点 |
 N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
N,P,As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题: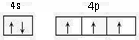 ,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.
,砷与同周期相邻元素的第一电离能由大到小的顺序为As>Se>Ge.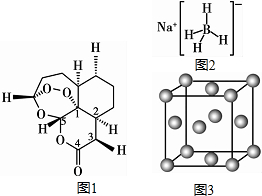 现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构
现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构