题目内容
18.关于如图所示的①、②两个装置的叙述,正确的是( )
| A. | 装置名称:①是原电池,②是电解池 | |
| B. | 电极反应式:①中阳极:4OH--4e-═2H2O+O2↑ ②中正极:2H++2e-═H2↑ | |
| C. | 硫酸浓度变化:①减小,②增大 | |
| D. | 离子移动方向:①中H+向阴极方向移动,②中H+向负极方向移动 |
分析 ①中有电源,是用惰性电极电解硫酸溶液的装置,为电解池,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,相对于电解水,阳离子移向阴极,②为Zn、Cu原电池,Zn为负极,正极上氢离子放电生成氢气,原电池中阳离子移向正极,据此分析.
解答 解:A、①中有电源,是用惰性电极电解硫酸溶液的装置,为电解池,②为Zn、Cu原电池,故A错误;
B、①为电解池,阳极上氢氧根离子放电生成氧气,②为Zn、Cu原电池,Zn为负极,正极上氢离子放电生成氢气,故B正确;
C、①电解硫酸相对于电解水,硫酸浓度增大,②正极上氢离子放电生成氢气,硫酸浓度减小,故C错误;
D、电解池中氢离子移向阴极,原电池中氢离子移向正极,故D错误;
故选B.
点评 本题考查了原电池和电解池的区分、电极反应原理以及电极反应式的书写、电解液浓度变化,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
8.在Cu、CuO、CuCO3、稀H2SO4和Na2SO4溶液五种物质中,每两种物质反应能生成CuSO4的方法有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
13.一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ/mol,下列不能说明反应达到平衡状态的是( )
| A. | 体系压强保持不变 | |
| B. | 混合气体颜色保持不变 | |
| C. | SO3的体积百分数保持不变 | |
| D. | 每消耗1 mol SO3的同时生成1 mol NO |
10.物质的量相同的不同物质其关系是( )
| A. | 两者质量一定相等 | B. | 两者体积相等 | ||
| C. | 两者所含指定的微粒数相等 | D. | 两者摩尔质量相等 |
7.对于物质的量浓度均为0.01mol/L的①NaHCO3、②Na2CO3、③CH3COOH、④CH3COONa四种溶液,下列说法正确的是( )
| A. | ①的离子浓度为:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | ②c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| C. | ③加入等体积的水稀释,电离平衡正向移动,c(H+)增大 | |
| D. | ④和③等体积混合,c(CH3COO-)+c(CH3COOH)=0.01 mol/L |

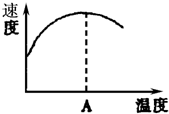 酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.
酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,如图表示酶参加的反应中,温度与反应速率的关系,解释曲线变化原因升高温度,增大反应速率,温度过高,使催化剂失去活性,反应速率减小.