题目内容
20.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )| A. | 质子数c>d | B. | 非金属性Y<Z | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径W>X |
分析 元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,以此解答该题.
解答 解:元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,
A.离子的电子层结构相同,则c+2=d+1,则质子数d>c,故A错误;
B.Y是O、Z是F元素,同一周期元素,非金属性随着原子序数增大而增强,所以非金属性Y<Z,故B正确;
C.非金属性越强,其氢化物的稳定性越强,非金属性Y<Z,则氢化物的稳定性H2Y<HZ,故C错误;
D.W是Al元素、X是Na元素,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径W<X,故D错误;
故选B.
点评 本题考查原子结构和元素性质,为高频考点,正确判断元素是解本题关键,熟练掌握同一周期、同一主族元素原子结构、元素性质递变规律,题目难度不大.

练习册系列答案
相关题目
10.废铅蓄电池的一种回收利用工艺流程如图所示:

部分难溶电解质的性质如表:
回答下列问题:
(1)在生产、生活中使用广泛,铅蓄电池的缺点有比能量低(写一条).
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:化学能→热能→机械能→电能.
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混台液经蒸发浓缩、冷却结晶等操作,可以析出十水硫酸钠晶体.
(4)利用铅泥中的PbS04溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,写出后一步生成PbO2的离子方程式(CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(5)25aC时,Na2CO3溶液浸出时发生的反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=1.2×10-5.以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程PbCO3$\frac{\underline{\;\;△\;\;}}{\;}$PbO+CO2↑、2PbO$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+CO2↑
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.设计实验区别PbCr04和BaCr04取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.

部分难溶电解质的性质如表:
| 物质 | Kap(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.8×10-20 | 白色 |
(1)在生产、生活中使用广泛,铅蓄电池的缺点有比能量低(写一条).
(2)燃烧废塑料外壳可以发电,其一系列能量转换过程:化学能→热能→机械能→电能.
(3)将流程图中的废硫酸和滤液按一定比例混合,再将所得的混台液经蒸发浓缩、冷却结晶等操作,可以析出十水硫酸钠晶体.
(4)利用铅泥中的PbS04溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,写出后一步生成PbO2的离子方程式(CH3COO)2Pb+ClO-+2OH-=Pb02↓+Cl-+2CH3COO-+H2O.
(5)25aC时,Na2CO3溶液浸出时发生的反应为:CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=1.2×10-5.以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程PbCO3$\frac{\underline{\;\;△\;\;}}{\;}$PbO+CO2↑、2PbO$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+CO2↑
(6)已知Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物.设计实验区别PbCr04和BaCr04取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.
11.反应C(s)+H2O(g)?CO(g)+H2(g)在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 保持体积不变,充入水蒸气使体系压强增大 | |
| B. | 将容器体积缩小一倍 | |
| C. | 增加C的量 | |
| D. | 加入催化剂 |
8.下列化学用语表述一定正确的是( )
| A. | 甲醛的电子式: | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
5.硒为第四周期VIA族元素,根据它在周期表中位置推测,硒不可能具有的性质( )
| A. | 单质有还原性 | B. | 硒元素在化合物中可显-2价 | ||
| C. | 硒化氢水溶液显弱碱性 | D. | 最高价氧化物的水化物显酸性 |
12.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2二溴乙烷 | |
| D. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 |
9.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L0.1 mol/L氨水中含有0.1NA NH3分子 | |
| B. | 46gNO2和N2O4混合气体中含有的原子数为3NA | |
| C. | 标准状况下,11.2 L CCl4中含有的分子数为0.5NA | |
| D. | 常温常压下,12g 14C所含原子数为NA |
10.pH是溶液中c(H+)的负对数,若定义pc是溶液中溶质物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示:
已知草酸的电离常数K${\;}_{{a}_{1}}$=5.6×10-2,K${\;}_{{a}_{2}}$=5.4×10-5
下列叙述正确的是( )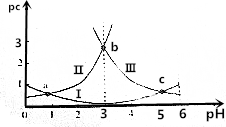
已知草酸的电离常数K${\;}_{{a}_{1}}$=5.6×10-2,K${\;}_{{a}_{2}}$=5.4×10-5
下列叙述正确的是( )

| A. | 曲线Ⅰ表示H2C2O4的变化 | |
| B. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| C. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等 | |
| D. | 常温下,$\frac{c({H}_{2}{C}_{2}{O}_{4})•c({C}_{2}{{O}_{4}}^{2-})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$随pH的升高先增大后减小 |
 下列实验设计或操作合理的是BGH
下列实验设计或操作合理的是BGH