题目内容
7.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中,以下叙述正确的是( )
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 甲、乙中SO${\;}_{4}^{2-}$都向铜片移动 | D. | 产生气泡的速率甲中比乙中快 |
分析 甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,原电池中阴离子移向负极,以此进行分析.
解答 解:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.乙中不构成原电池,铜片不是电极,故B错误;
C.甲中形成的是原电池反应,铜片上氢离子得电子生成氢气,乙中是锌直接和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中甲中硫酸根离子移向锌片,乙中硫酸根离子进入溶液不移向到铜片,故C错误;
D.甲能形成原电池加快反应速率,乙不能构成原电池,所以产生气泡的速度甲比乙快,故D正确;
故选D.
点评 本题考查了置换反应和原电池的有关知识,题目难度不大,注意把握原电池的组成条件的工作原理.

练习册系列答案
相关题目
17.X、Y是短周期元素,两者组成化学式为X2Y2的化合物,已知X的原子序数为n,则Y的原子序数可能是( )
(1)n+3(2)n-3(3)n+5(4)n-5(5)n+11.
(1)n+3(2)n-3(3)n+5(4)n-5(5)n+11.
| A. | (1)(2)(3) | B. | (2)(4) | C. | (1)(4)(5) | D. | 全部 |
15.在下列物质中,分别加入金属钠,不能产生氢气的是( )
| A. | 蒸馏水 | B. | 无水酒精 | C. | 苯 | D. | 75%的酒精 |
2.原电池的构成具有一定的条件,这些条件是( )
①电极②电解质溶液③闭合回路④盐桥⑤有自发的氧化还原反应发生.
①电极②电解质溶液③闭合回路④盐桥⑤有自发的氧化还原反应发生.
| A. | ①②③④ | B. | ①②③⑤ | C. | ①④⑤ | D. | ②③④ |
19.人造地球卫星用到的一种高能电池-银锌电池,它在放电时的电极反应为:Zn+2OH--2e-═ZnO+H2O,Ag2O+H2O+2e-═2Ag+2OH-.据此判断,氧化银是( )
| A. | 负极,被氧化 | B. | 负极,被还原 | C. | 正极,被还原 | D. | 正极,被氧化 |
17.下列说法正确的是( )
| A. | H2、D2、T2属于同位素 | |
| B. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| C. | 水能、风能、生物质能是可再生能源,煤、石油是不可再生能源 | |
| D. | HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH不是电解质 |

 ②
②
 可选用的试剂有bd(填标号)
可选用的试剂有bd(填标号)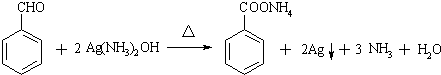 .
. 的合成路线流程图(无机试剂任用)合成路线流程图示例如下:CH2═CH2$→_{催化剂,△}^{H_{2}O}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用)合成路线流程图示例如下:CH2═CH2$→_{催化剂,△}^{H_{2}O}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.