题目内容
10.下列关于阿伏加德罗常数的说法正确的是( )| A. | 阿伏加德罗常数是12 g碳中所含的碳原子数 | |
| B. | 24 g镁的原子最外层电子数为NA | |
| C. | 阿伏加德罗常数约是6.02×1023 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 mol-1 |
分析 A、12g12C中含有的碳原子数称为阿伏伽德罗常数;
B、求出镁的物质的量,然后根据镁原子的最外层有2个电子来分析;
C、阿伏伽德罗常数的单位为mol-1;
D、阿伏伽德罗常数的符号为NA,单位为mol-1;
解答 解:A、碳元素有多种碳原子,只有12g12C中含有的碳原子数称为阿伏伽德罗常数,故A错误;
B、24g镁的物质的量为1mol,而镁原子的最外层有2个电子,故1mol镁的最外层有2NA个电子,故B错误;
C、阿伏伽德罗常数的单位为mol-1,数值为6.02×1023,即阿伏伽德罗常数为6.02×1023mol-1,故C错误;
D、阿伏伽德罗常数的符号为NA,单位为mol-1,数值为6.02×1023,即阿伏伽德罗常数为6.02×1023mol-1,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的定义、符号以及数值,难度不大,应注意的是阿伏伽德罗常数的单位为mol-1.

练习册系列答案
相关题目
15.电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2 ( )2L


| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能确定 |
5.对人类生存环境不会造成危害的是( )
| A. | 生活污水的任意排放 | B. | 所有绿色植物的光合作用 | ||
| C. | 废电池的随意丢弃 | D. | 化肥和杀虫剂的大量使用 |
20.为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
根据以上表格内容回答:
(1)实验①中Mg作负极(填“正极”或“负极”),发生氧化反应(填“氧化反应”或“还原反应”).实验③中Mg作正极(填“正极”或“负极”),总反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑.
(2)实验②中Al电极上的电极反应式为2H++2e-═H2↑;.
(3)实验④中正极的电极反应式为NO3-+3e-+4H+=NO↑+2H2O.这样构成的原电池与常见的原电池不同,原因是铝在浓硝酸中发生了钝化.
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg-Al | HNO3(浓) | Mg→Al |
| ② | Mg-Al | HCl(aq) | Mg→Al |
| ③ | Mg-Al | NaOH(aq) | Al→Mg |
| ④ | Al-Cu | HNO3(浓) | Cu→Al |
(1)实验①中Mg作负极(填“正极”或“负极”),发生氧化反应(填“氧化反应”或“还原反应”).实验③中Mg作正极(填“正极”或“负极”),总反应的离子方程式为:2Al+2OH-+2H2O=AlO2-+3H2↑.
(2)实验②中Al电极上的电极反应式为2H++2e-═H2↑;.
(3)实验④中正极的电极反应式为NO3-+3e-+4H+=NO↑+2H2O.这样构成的原电池与常见的原电池不同,原因是铝在浓硝酸中发生了钝化.
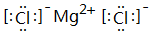 ,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.
,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.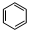 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$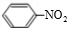 +H2O.
+H2O.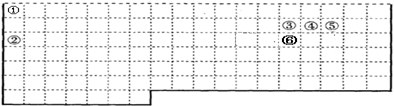
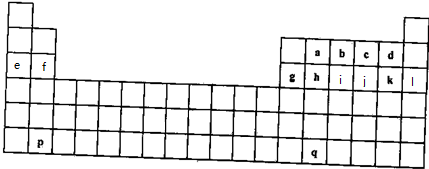
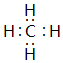 ,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2.
,上述元素中,能和⑤号元素形成正四面体空间网状结构的化合物的化学式是SiO2.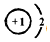 、
、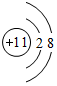 .
.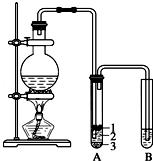 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: